Bs. Hoàng Văn Trung
1. Tóm tắt (Abstract)
Bệnh vú của trẻ em là không phổ biến và ung thư vú nguyên phát ở trẻ em là cực kỳ hiếm. Do đó, cách tiếp cận để giải quyết các tổn thương vú ở trẻ em khác với ở người lớn theo nhiều cách. Kiến thức về các đặc điểm hình ảnh bình thường ở các giai đoạn phát triển khác nhau và đặc điểm của bệnh lý vú ở trẻ em có thể giúp bác sĩ chẩn đoán tự tin và giúp quản lý bệnh nhân một cách hợp lý. Hầu hết các bệnh vú ở trẻ em là lành tính hoặc có liên quan đến sự phát triển vú, do đó khuyến nghị cần phải điều trị bảo tồn. Các thủ tục can thiệp có thể ảnh hưởng đến mô vú đang phát triển và nên được chỉ định một cách hạn chế trong một số trường hợp. Kiểm tra mô học (histologic examination) nên được thực hiện ở bệnh nhi (pediatric patients), có liên quan đến kích thước của tổn thương và tiền sử lâm sàng cùng với các phát hiện hình ảnh. Sinh thiết lõi (a core needle biopsy) là hữu ích để giúp chẩn đoán chính xác và tránh các hư hại không thể khắc phục. Sinh thiết phải được xem xét trong trường hợp phát hiện hình ảnh bất thường, chẳng hạn như bờ không rõ, thành phần đặc và nang phức tạp, bóng cản âm sau, kích thước trên 3cm hoặc gia tăng kích thước của tổn thương. Tiền sử lâm sàng bao gồm yếu tố nguy cơ ác tính, chẳng hạn đã từng chiếu xạ trước ngực, một loại ung thư ngoài vú đồng thời đã biết hoặc tiền sử gia đình mắc ung thư vú. Nên xem xét sinh thiết ngay lập tức ngay cả khi tổn thương có vẻ ngoài lành tính trên siêu âm.
2. Giới thiệu (Introduction)
Tổn thương vú (breast lesions) ở trẻ em và thanh thiếu niên (children and adolescents) là rất hiếm và khác với tổn thương vú ở người trưởng thành ở một vài khía cạnh. Đầu tiên, bệnh vú ở trẻ em và thanh thiếu niên chủ yếu là các tổn thương lành tính liên quan đến sự phát triển bình thường của vú và các khối u lành tính. Thứ hai, bệnh ác tính ở trẻ em và thanh thiếu niên rất hiếm (1, 2, 3, 4, 5). Ung thư vú ở thanh thiếu niên chiếm 0,1% trong tất cả các loại ung thư vú và dưới 1% trong tất cả các loại ung thư ở trẻ em (1, 2, 3, 6). Thứ ba, phương pháp hình ảnh lâm sàng được sử dụng để kiểm soát các tổn thương vú ở trẻ em và thanh thiếu niên khác với các phương pháp được sử dụng để phát hiện sớm ung thư vú ở người lớn, và xu hướng ở trẻ em và thanh thiếu niên hiếm khi có các tổn thương ác tính (1, 2, 3, 7, 8). Với những khác biệt này, việc kiểm soát bệnh vú ở trẻ em và thanh thiếu niên nên khác với người lớn.
Hầu hết các tổn thương vú ở trẻ em được quản lý bảo tồn. Điều trị can thiệp có thể ảnh hưởng đến việc phát triển chồi vú (breast buds) ở trẻ em và thanh thiếu niên, do đó nên thận trọng dựa trên các đặc điểm lâm sàng và hình ảnh (1, 2, 7).
Các bác sĩ chẩn đoán hình ảnh nên nhận thức được các đặc điểm của bệnh vú ở trẻ em và nhận ra sự khác biệt giữa trẻ em và người lớn nhằm mục đích đánh giá và quản lý thích hợp. Bài viết này xem xét chẩn đoán phân biệt các tổn thương vú ở trẻ em và thanh thiếu niên, bao gồm sự phát triển của bệnh lành tính và ác tính, và đưa ra khuyến nghị quản lý.
3. Đánh giá hình ảnh vú trẻ em (Normal development of the breast)
Đánh giá hình ảnh của vú người lớn được thực hiện để chẩn đoán sớm ung thư vú. Chụp nhũ ảnh (mammography) có thể chẩn đoán bệnh ác tính với vi vôi hóa (microcalcifications); do đó, nó là phương thức hình ảnh đầu tiên. Tuy nhiên, chụp nhũ ảnh thường không được thực hiện ở trẻ em vì tuyến vú của trẻ em đang phát triển và rất nhạy cảm với bức xạ ion hóa. Hơn nữa, thanh thiếu niên có mô vú dày với nhiều mô sợi. Do đó, siêu âm là phương pháp thích hợp vì nó có thể phát hiện các tổn thương của mô vú dày và tránh cho bệnh nhi tiếp xúc với các bức xạ ion hóa (1, 2, 7, 8). Các vấn đề tâm lý nên được lưu ý khi thực hiện siêu âm vú ở trẻ em gái và thanh thiếu niên, những người có thể có các phản ứng nhạy cảm với việc kiểm tra vú, vì vậy cần sàng lọc thích hợp và đảm bảo sự thoải mái. Kiểm tra siêu âm có thể được thực hiện bằng cách sử dụng đầu dò tuyến tính phẳng độ phân giải cao với tần số khoảng 15-17MHz. Một mốc hữu ích để xác định ranh giới sau vú là cơ ngực (1, 3). Các bác sĩ chẩn đoán hình ảnh nên biết những cạm bẫy liên quan đến cấu trúc giải phẫu bình thường được thấy trên siêu âm. Xương sườn hoặc núm vú có thể bị nhầm lẫn với một tổn thương bất thường. Khi cắt ngang, phần sụn của xương sườn có thể bắt chước một khối vú. Xương sườn nằm ở phía sau trong cơ ngực cho thấy bóng cản âm mạnh hơn, xuất hiện như một tổn thương kéo dài khi cắt dọc. Đôi khi, bệnh nhân phàn nàn về chỗ nối sụn xương như một khối sờ thấy được (Hình 1).
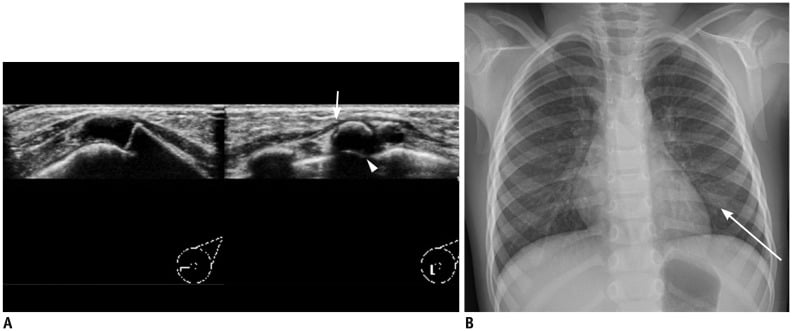
Hình 1. Bé gái 3 tuổi bị tổn thương sờ thấy được ở vú trái. (A) Trên hình ảnh siêu âm, chỗ nối sụn sườn bình thường được nhìn thấy khi quét ở vùng sờ thấy. Lưu ý rằng xương sườn nằm ở phía sau cơ ngực (mũi tên), hiển thị bóng cản âm sau (đầu mũi tên). Không có bất thường được ghi nhận trong nhu mô vú. (B) Xquang ngực cho thấy sự phân nhánh của xương sườn 5 bên trái tại điểm nối sụn sườn, gợi ý xương sườn chẻ đôi (mũi tên).
Dây chằng Cooper là những cấu trúc bình thường, có bóng lưng sau. Bất kỳ cấu trúc nào trong số này có thể bị hiểu sai là bất thường. Xác nhận những đặc điểm này là bình thường trên siêu âm bằng cách loại trừ bóng lưng sau thông qua điều chỉnh góc của đầu dò và kiểm soát lực nhấn (1, 8). Núm vú cũng tạo ra một bóng cản âm mạnh phía sau và có thể bị hiểu sai là một khối dưới quầng vú. Ép và chỉnh góc đầu dò thích hợp có thể loại bỏ bóng âm sau, cho phép cấu trúc giải phẫu dễ dàng được nhận ra là bình thường trên siêu âm theo thời gian thực. Một thùy mỡ đôi khi được xem như một khối đặc đồng hồi âm, đặc biệt là trong nhu mô vú. Tuy nhiên, thùy mỡ có thể được xem như một cấu trúc bình thường bằng cách xoay đầu dò và xác nhận sự liên tục của nó với các mô mỡ bình thường xung quanh (9).
CT được sử dụng để kiểm tra bệnh lý lồng ngực ở trẻ em và có thể tìm thấy các tổn thương ở vú (Hình 2) (1, 2). Hình ảnh MRI vú không được sử dụng rộng rãi ở bệnh nhi, nhưng có thể tạo điều kiện thuận lợi cho việc lập kế hoạch phẫu thuật và xác định dị dạng mạch máu hoặc bạch mạch tại các vị trí giải phẫu khác nhau (Hình 3B) (1, 2, 8). Giống như ở người lớn, khối tổn thương vú ở bệnh nhi có thể được đánh giá về hình thái và huyết động bằng MRI.
Vú phụ nữ trải qua hai giai đoạn phát triển. Giai đoạn đầu tiên bắt đầu từ lúc 5-6 tuần tuổi thai. Các tế bào biểu bì (epidermal cells) xâm nhập và gò vú nguyên phát bắt đầu phát triển từ nách đến bẹn. Sự xâm nhập của các dòng sữa xuất hiện ngoại trừ ở mức khoảng liên sườn thứ tư nơi sẽ hình thành chồi vú bình thường. Các chồi vú còn lại ở khoảng gian sườn thứ tư phát triển thành các chồi thứ cấp và sau đó hình thành các ống dẫn sữa phân nhánh trong nhu mô của vú. Một vết lõm nhỏ hình thành trên bề mặt da, lấn qua các chồi vú và phát triển thành một phức hợp núm vú (1, 2, 3, 7, 8). Các nốt dưới quầng vú hai bên là phổ biến ở trẻ sơ sinh. Đây là những biểu hiện tạm thời của sự phát triển sinh lý để đáp ứng với kích thích tố của mẹ và sẽ biến mất trong vòng 12 tháng (Hình 3). Các chồi vú thường có kích thước không đối xứng và xuất hiện thành cụm trong giai đoạn phát triển đầu tiên. Sự phát triển vú một bên có thể là do sự xuất hiện của một khối u dưới quầng vú (1, 2, 3, 7, 8, 10).

Hình 2. Cô bé 15 tuổi được chụp CT để đánh giá chấn thương. (A) CT scan cho thấy khối ngấm thuốc ở vú trái (mũi tên). (B) Hình ảnh siêu âm cho thấy khối lành tính ở vú trái có tương quan với kết quả CT. Bệnh nhân này đã được theo dõi mà không có xác nhận của mô bệnh học, đây có lẽ là tổn thương lành tính.
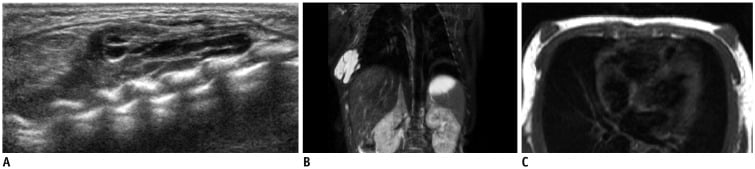
Hình 3. Phát hiện ở một bé trai 1 ngày tuổi có khối sờ thấy ở khối bên phải của thành ngực. (A) Hình ảnh siêu âm cho thấy u nang có vách ngăn mỏng gợi ý dị dạng bạch mạch (lymphangioma). (B) Hình ảnh MRI, chuỗi xung T2W có xóa mỡ cho thấy tế bào dị dạng bạch mạch có tín hiệu cao và có vách ngăn mỏng. (C) Hình ảnh MRI chuỗi xung T1W cho thấy sự tăng sinh của mô tuyến ở khu vực dưới quầng vú hai bên và do mô tuyến sinh lý mở rộng dưới ảnh hưởng của hormon mẹ.
Giai đoạn phát triển thứ hai xảy ra trong thời niên thiếu và được gọi là nhú núm vú (thelarche). Hormone ảnh hưởng đến sự phát triển của chồi vú ở các bé gái vị thành niên. Estrogen có liên quan đến sự kéo dài và biệt hóa của các ống dẫn sữa trong khi progesterone thúc đẩy sự phát triển của các thùy tận cùng (terminal lobules). Tuổi trung bình khởi phát của giai đoạn nhú núm vú là 9,8 tuổi. Giai đoạn nhú núm vú sớm được định nghĩa là khởi phát trước 8 tuổi và giai đoạn muộn được định nghĩa là khởi phát sau 13 tuổi (Hình 4) (1, 2, 3, 8, 11). Sự phát triển sớm của vú có thể xảy ra độc lập hoặc liên quan đến dậy thì sớm. Nhú núm vú sớm vô căn có thể xảy ra ở những bé gái 1-3 tuổi; điều này không liên quan đến dậy thì sớm và thường thoái lui, do đó, nó đủ để trấn an bệnh nhân và người nhà (Hình 5). Khi chồi vú dưới quầng vú giảm hồi âm được xác định trên siêu âm mà không có dấu hiệu dậy thì sớm khác, thì chỉ cần theo dõi lâm sàng là đủ và không cần thêm hình ảnh khác hay can thiệp (1, 2, 3, 8). Tuy nhiên, nếu sự phát triển vú sớm có liên quan đến các triệu chứng phát dục trưởng thành thứ phát, thì cần các đánh giá tiếp theo, bao gồm xác định tuổi xương và siêu âm bụng chậu. Điều này là cần thiết để đánh giá sự phát triển của tử cung buồng trứng và loại trừ khối u tuyến thượng thận (1, 2, 3, 8) (Hình 6).
Hình 4. Hình ảnh siêu âm của cô gái 18 tuổi với bất sản thể chai. (A) Siêu âm vú cho thấy giảm sản mô tuyến vú hai bên. (B) Siêu âm vùng chậu cho thấy tử cung chưa trưởng thành, gợi ý về tình trạng kém phát triển sinh dục.
Hình 5. Hình ảnh siêu âm cho bé gái 1 tuổi có khối sờ thấy ở cả hai vú. Hình ảnh cho thấy sự tăng sinh mô tuyến ở khu vực dưới quầng vú hai bên với không có dấu hiệu dậy thì sớm. Theo dõi lâm sàng là đủ và không cần thêm hình ảnh hay can thiệp.
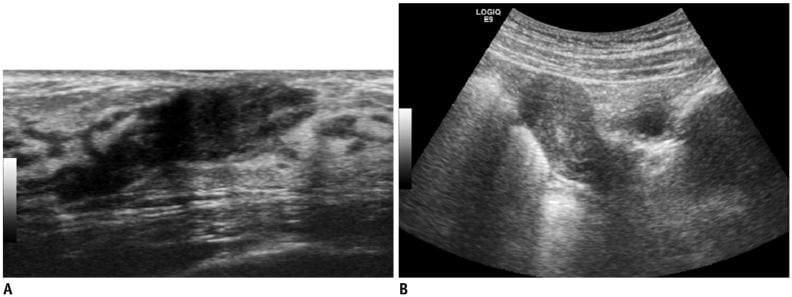
Hình 6. Hình ảnh siêu âm bé gái 9 tuổi được chẩn đoán có khối u ở mỗi vú 6 tháng trước đó. (A) Hình ảnh siêu âm của vú cho thấy dải giảm âm của mô tuyến trong khu vực dưới quầng vú (giai đoạn Tanner 3). (B) Hình ảnh siêu âm của khung chậu cho thấy tử cung mở rộng với buồng trứng có thể tích bình thường (không hiển thị).
Các giai đoạn phát triển của tuổi thiếu niên dựa trên thang điểm Tanner (Tanner scale). Sự phát triển vú được chia thành năm giai đoạn lâm sàng. Vú trên siêu âm có thể được sử dụng để thu được các hình ảnh phản ánh năm giai đoạn của thang điểm Tanner. Các phát hiện trên siêu âm có thể trùng lặp giữa giai đoạn Tanner 2 và 4. Tuy nhiên, có mối tương quan giữa estrogen và đánh giá sự phát triển của mô vú bằng cách sử dụng siêu âm (1, 2, 3, 8). Một so sánh của siêu âm về các giai đoạn Tanner 1-5 được biểu hiện trong Hình 7 (1, 2, 3, 8, 12).
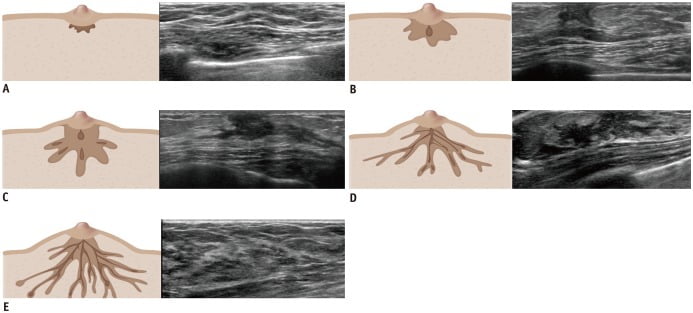
Hình 7. Siêu âm so sánh các giai đoạn Tanner (Tanner stages). (A – Giai đoạn Tanner 1) Sự nâng lên của nhú có thể được nhìn thấy trên lâm sàng. Siêu âm cho thấy một vùng nhỏ có hồi âm ở vùng dưới quầng vú. (B – Giai đoạn Tanner 2) Sự nâng lên của vú và nhú có thể được nhìn thấy trên lâm sàng với một vùng nhỏ ở khu vực quầng vú. Siêu âm cho thấy chồi giảm âm dưới quầng vú với mô vú tăng âm bao gồm mô mỡ và mô liên kết lỏng lẻo. (C – Giai đoạn Tanner 3) Một nốt dưới quầng vú được sờ thấy trên lâm sàng với sự mở rộng nhiều hơn của vú và quầng vú được ghi nhận mà không tách rời giới hạn của chúng. Siêu âm cho thấy sự mở rộng của mô sợi tuyến tăng âm với dải giảm âm ở trung tâm giống như mạng nhện đi ra từ vùng sau quầng vú (retroareolar region), phản ánh các ống tuyến giãn dài ra (elongated ducts). (D – Giai đoạn Tanner 4) Lâm sàng biểu hiện gò nhô lên trên vú, bao gồm quầng vú và nhú hình thành thứ phát với sự phân tách giới hạn của chúng. Siêu âm cho thấy chồi vú giảm âm kéo dài và giãn rộng hơn, và mất đi dáng vẻ hình tròn. Lớp mỡ dưới da có thể hiện diện. (E – Giai đoạn Tanner 5) Biểu hiện lâm sàng của nhú chỉ với suy thoái của quầng vú tới giới hạn chung của vú. Siêu âm cho thấy sự xuất hiện của vú trưởng thành, hồi âm không đồng nhất của nhu mô vú với hồi âm xen kẽ của mô tuyến và mô đệm, và gia tăng lượng mỡ dưới da.
4. Bất thường bẩm sinh và mắc phải của vú (Congenital and developmental abnormalities of the breast)
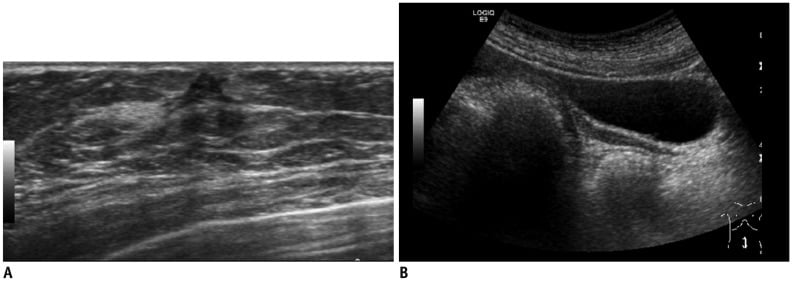
Núm vú phụ (accessory nipple hoặc polythelia) và vú phụ (accessory breast hoặc polymastia) là những bất thường bẩm sinh liên quan đến sự thoái triển không hoàn toàn của dải vú. Những bất thường này có thể xảy ra ở bất cứ nơi nào nằm dọc từ nách đến bẹn, nhưng thường xảy ra nhất ở nách hoặc dưới nếp vú (2, 3). Núm vú phụ được tìm thấy trong khoản 1-2% dân số và có thể bị chẩn đoán nhầm về mặt lâm sàng là bớt da hoặc sắc tố (1, 2, 3, 7, 13). Trên lâm sàng, vú phụ ở nách (accessory breast in the axilla) thường có biểu hiện đau theo chu kỳ với vùng nách bị nhô ra (protruded axilla). Siêu âm có thể xác nhận sự hiện diện của mô sợi tuyến (fibroglandular tissue ) ở nách (Hình 8) (1, 2, 3, 7, 8). Giảm sản vú (hypoplasia) và tật không vú (amasti, tức là không có mô vú, núm vú và quầng vú) là rất hiếm và xảy ra trong hội chứng Poland (Hình 9). Bất sản vú (amazia) khác với tật không vú (amastia) ở chỗ có tồn tại núm vú và quầng vú nhưng mô vú bên dưới không có; nó có thể là do sự cắt bỏ chồi vú (breast buds) trong điều trị hoặc xạ trị (radiation therapy) trước tuổi thiếu niên (1, 2, 14, 15).
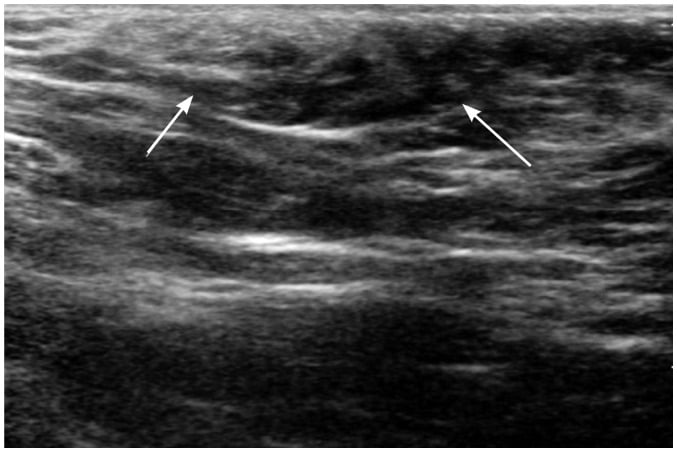
Hình 8. Hình ảnh siêu âm vú của bé gái 12 tuổi có một khối ở nách trái. Hình ảnh cho một vùng khu trú của mô sợi tuyến không đồng nhất nằm trong lớp mỡ dưới da ở nách trái (các mũi tên) tương tự như của vú.
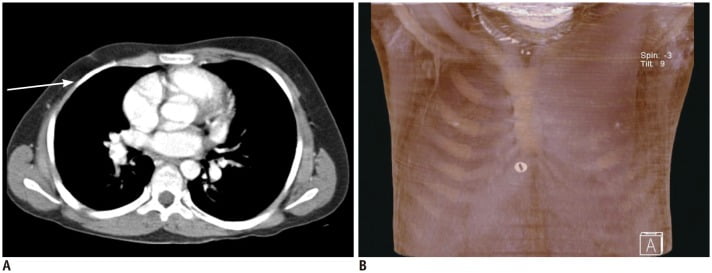
Hình 9. Hội chứng Poland ở cậu bé 13 tuổi. CT axial và tái tạo MIP cho thấy không có cơ ngực ở thành ngực phải (mũi tên).
(Xem chi tiết hội chứng này ở đây: Hội chứng Poland)
5. Phì đại vú ở nam giới (Gynecomastia)
Gynecomastia đề cập đến sự phát triển quá mức của mô vú ở nam giới, bao gồm trẻ sơ sinh, thanh thiếu niên và đàn ông trưởng thành (16). Khoảng 60-75% trường hợp xảy ra ở trẻ vị thành niên (3). Trên lâm sàng, bệnh nhân bị phì đại vú mô tả về một khối sờ thấy hoặc đau vùng dưới da vú. Gynecomastia xuất hiện dưới dạng phì đại một bên vú hoặc phì đại không đối xứng hai bên vú. Nó được cho là do sự kích hoạt bởi sự mất cân bằng nồng độ estrogen và testosterone. Leptin, đây là một loại enzyme trong mô mỡ, đóng vai trò làm tăng nồng độ estrogen và dẫn đến sự phát triển của mô vú nam giới. Các loại thuốc như steroid đồng hóa (anabolic steroids), thuốc chống trầm cảm (antidepressants) và kháng sinh (antibiotics) cũng có thể gây ra gynecomastia (1, 2, 3, 8). Điều quan trọng là giải thích cho bệnh nhân và người nhà rằng gynecomastia ở trẻ sơ sinh và thanh thiếu niên thường biến mất trong vòng hai năm. Tuy nhiên, gynecomastia quá mức và dai dẳng có thể cần phải đánh giá thêm để tìm các khối u tế bào Sertoli-Leydig tinh hoàn (Sertoli-Leydig testicular), u vỏ thượng thận (adrenocortical) hoặc u nguyên bào gan (hepatoblastoma) có thể sản xuất estrogen. Khả năng mắc bệnh về gan hoặc hội chứng Klinefelter cũng nên được xem xét (1, 2, 7, 8). Khi có một khối dưới vú được sờ thấy được, siêu âm có thể xác định sự gia tăng mô sợi tuyến dưới quầng vú (increased subareolar fibroglandular tissue) và loại trừ các khối u (Hình 10). Đôi khi, bệnh nhân béo phì (obese patients) có thể phát triển tổn thương giả gynecomastia (pseudogynecomastia), được đặc trưng bởi phì đại mô mỡ nhưng không chứa mô sợi tuyến (1, 3).
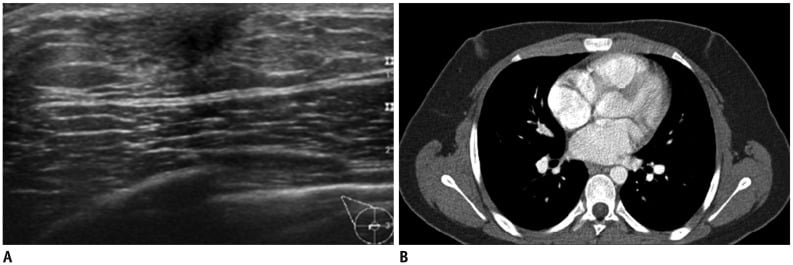
Hình 10. Phì đại mô vú nam giới (gynecomastia) ở một thanh niên 18 tuổi với khối sờ thấy ở vùng dưới quầng vú cả hai bên. (A) Hình ảnh siêu âm cho thấy mô tuyến vú bình thường ở các vùng dưới quầng vú hai bên vú, gợi ý gynecomastia. (B) Hình ảnh chụp CT cho thấy đậm độ mô mềm dạng đường hoặc dạng ống ở vùng dưới quầng vú của cả hai vú.
6. Các tổn thương vú không tân sinh (Non-neoplastic breast lesions)
Các nang đơn thuần ở vú trưởng thành thường được tìm thấy ở độ tuổi 35-50, nhưng cũng có thể xuất hiện ở mọi lứa tuổi. Những tổn thương này nằm trong phổ bệnh xơ nang (fibrocystic disease) và có thể phát sinh do giãn tiểu thùy tuyến (dilated lobular acini) do mất cân bằng giữa sự bài tiết (fluid secretion) và hấp thu (absorption) hoặc sự tắc nghẽn (obstruction) của ống dẫn (17). Nang vú ở tuổi thiếu niên xuất hiện như một khối không có triệu chứng bên cạnh núm vú, và ở một số bệnh nhân có thể đi kèm với viêm hoặc các triệu chứng khác như tiết sữa (2, 3, 18). Trên siêu âm, nang xuất hiện dưới dạng một khối tròn tới bầu dục trống âm, với sự tăng mạnh âm sau và không có mạch máu trên siêu âm Doppler màu. Các nang không triệu chứng đơn thuần (simple asymptomatic cysts) với các đặc điểm hình ảnh điển hình không cần điều trị đặc hiệu hoặc kiểm tra thêm hoặc can thiệp. Tuy nhiên, các nang có các đặc điểm hình ảnh không điển hình, chẳng hạn như có hồi âm bên trong, mức dịch-dịch, có vách hoặc thành dày, có thể yêu cầu chọc hút để phân biệt với các chẩn đoán khác như nang sữa (galactocele), áp xe hoặc u nang phức hợp (1, 4, 8).
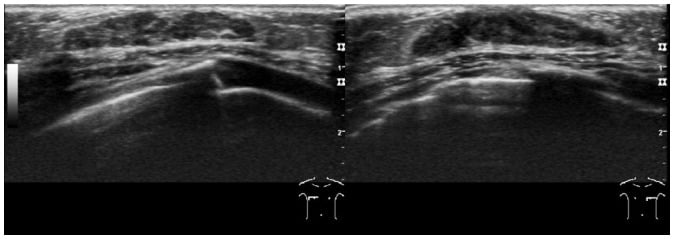
Giãn ống dẫn tuyến sữa (duct ectasia) là một thực thể hiếm gặp xảy ra ở trẻ sơ sinh và trẻ nhỏ (newborns and young children). Trên lâm sàng, bệnh nhân bị giãn ống tuyến xuất hiện chảy máu từ núm vú (bloody discharge from the nipple) hoặc có một khối sờ thấy ở vú (a palpable mass in the breast). Trên siêu âm xuất hiện dưới dạng các khối dạng nang có nhiều vách (multiseptate cyst-like masses) hoặc các cấu trúc hình ống không có hồi âm (tubular anechoic structures) được nhìn thấy ở các vùng dưới quầng vú (Hình 11). Nguyên nhân của giãn ống tuyến không rõ, nhưng nội tiết tố của mẹ (maternal hormones) có thể đóng vai trò quan trọng. Điều trị bảo tồn (conservative treatment) được chỉ định ở trẻ sơ sinh nếu có những đặc điểm này. Nên ngừng cho con bú (breast-feeding should be stopped) và nên sử dụng kháng sinh khi cần thiết (antibiotics should be used when necessary) (1, 2, 8).
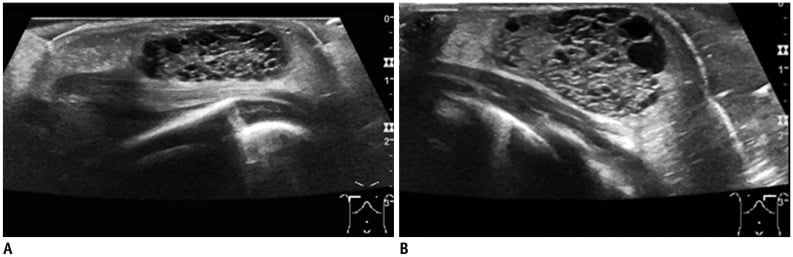
Hình 11. Giãn ống tuyến ở bé trai 3 ngày tuổi với khối u ở vùng dưới quầng vú hai bên. Hình ảnh siêu âm cho thấy một khối dạng nang nhiều vách không đồng nhất ở vùng dưới quầng vú hai bên.
Viêm vú (mastitis) và áp xe (abscess) là phổ biến ở phụ nữ cho con bú (lactating women). Tuy nhiên, chúng cũng có thể xảy ra ở trẻ em với sự phân bố dạng hai đỉnh (bimodal distribution) bao gồm trẻ sơ sinh (<2 tháng tuổi) và trẻ lớn hơn (8-17 tuổi) (5). Viêm vú là một chẩn đoán lâm sàng dựa trên các dấu hiệu và triệu chứng của nhiễm trùng, tức là sốt, đỏ và đau (fever, erythema, and tenderness). Tụ cầu (staphylococcus) hoặc phế cầu (pneumococci) là nguyên nhân gây bệnh phổ biến nhất ở tuổi thiếu niên (1, 4, 7, 8). Siêu âm rất hữu ích khi thực hiện FNA (fine-needle aspiration) cho mục đích chẩn đoán và điều trị. Trên siêu âm, áp xe xuất hiện dưới dạng cấu trúc dạng nang phức hợp, thành dày biến đổi và được bao quanh bởi các mạch máu tăng sinh gia tăng (Hình 12) (1, 2, 3, 4, 7, 8). Điều trị viêm vú kèm áp xe bao gồm điều trị bằng kháng sinh và dẫn lưu bằng chọc hút. Một áp xe lớn có thể yêu cầu phẫu thuật rạch bỏ (surgical incision) và dẫn lưu (drainage) (1, 2, 3, 7, 8).
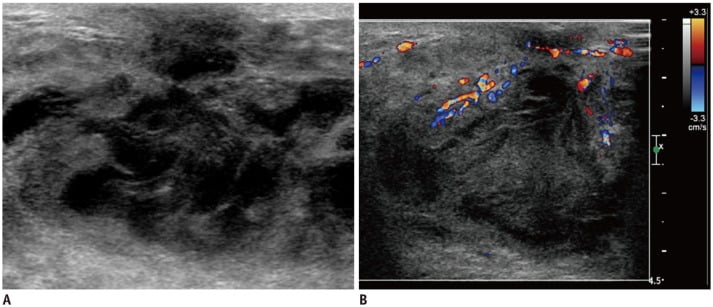
Hình 12. Hình ảnh siêu âm của bé gái 19 tuổi có tiền sử 2 tuần đỏ và đau ở vú phải. (A) Hình ảnh cho khối dạng nang có hồi âm không đồng nhất với thâm nhiễm mỡ lan tỏa trong mô vú, cho thấy áp xe. (B) Doppler màu cho thấy sự gia tăng mạch máu gợi ý tình trạng tăng sinh mạch do viêm.
Galactocele là một nang lắng đọng chứa đầy sữa (a retention cyst filled with milk) gây ra bởi sự tắc nghẽn của ống dẫn sữa (obstruction of a lactiferous duct). Nó thường được thấy ở phụ nữ mang thai hoặc cho con bú (pregnant or lactating women). Tuy nhiên, galactocele cũng có thể được nhìn thấy ở trẻ sơ sinh và thanh thiếu niên. Trên siêu âm, galactocele cho thấy các đặc điểm hình ảnh khác nhau tùy thuộc vào thành phần tương đối của mỡ và nước (từ nang trống âm đến nang phức tạp). Siêu âm chẩn đoán galactocele khi có mức dịch-mỡ trong nang (1, 2, 7, 8). Galactocele không biến chứng (uncomplicated galactoceles) có đặc điểm hình ảnh điển hình sẽ tự giới hạn và không cần đánh giá hoặc điều trị thêm. Cũng như các u nang đơn thuần (simple cysts), nên thực hiện FNA dưới hướng dẫn của siêu âm ở những bệnh nhân có triệu chứng và những người có đặc điểm hình ảnh không điển hình (1, 2, 7, 19).
Máu tụ (hematoma) hoặc hoại tử mỡ (fat necrosis) có thể liên quan đến tiền sử chấn thương hoặc phẫu thuật vú. Tiền sử chấn thương hoặc phẫu thuật gần đây là điểm mấu chốt để chẩn đoán (1). Siêu âm khối máu tụ cho thấy sự thay đổi theo thời gian tùy thuộc vào mức độ hóa lỏng (degree of liquefaction). Khối máu tụ xuất hiện dưới dạng một tổn thương tăng hồi âm khu trú (hyperechoic focal lesion) với bờ không rõ (ill-defined margin) ở giai đoạn cấp (acute phase) và sau đó biến đổi thành một tổn thương dạng nang với các mảnh vụn và vách bên trong (cystic lesion with internal debris and septations) (1, 2, 8). Trên siêu âm, hoại tử mỡ thường nằm ở lớp mỡ dưới da (subcutaneous fat layer), biểu hiện nhiều dạng hồi âm từ dạng nang đặc hỗn hợp đến dạng nang dầu tùy theo giai đoạn của tổn thương (20). Theo dõi ngắn hạn bằng hình ảnh được khuyến cáo ở những bệnh nhân có tiền sử lâm sàng và đặc điểm hình ảnh điển hình. Các đặc điểm hình ảnh không điển hình hoặc tăng trưởng theo thời gian là dấu hiệu cho thấy cần chọc hút cho cả mục đích chẩn đoán và điều trị (1, 2).
7. Các khối lành tính (Benign masses)
Bướu sợi tuyến là khối u lành tính phổ biến nhất ở trẻ em và thanh thiếu niên, chiếm 54-94% các trường hợp. Các mô sợi (fibroepithelial tissue) của u tuyến là một sự tăng sinh lành tính có thể sờ thấy trên lâm sàng (1, 2, 4, 5). Bướu sợi tuyến rất nhạy cảm với estrogen và phát triển nhanh chóng trong thời kỳ mang thai và dậy thì (21). Bướu sợi tuyến được phân loại theo kích thước và đặc điểm mô học của nó. Loại phổ biến nhất là bướu sợi tuyến thông thường, thường có kích thước 2-3cm (22). Nếu một bướu sợi tuyến lớn hơn 5-10cm, nó được gọi là bướu sợi tuyến khổng lồ (Hình 13). Bướu sợi tuyến ở trẻ vị thành niên (Juvenile fibroadenoma) là một biến thể tương đối hiếm gặp của bướu sợi tuyến với sự tăng sinh và phát triển nhanh của mô tế bào, chiếm 7-8% trường hợp (1, 2, 5, 8). Đặc điểm siêu âm điển hình của bướu sợi tuyến bao gồm một khối giảm âm có hình tròn hoặc hình bầu dục, giới hạn rõ và trục ngang (Hình 14). Tăng âm sau thường được nhìn thấy và thay đổi lưu lượng máu có thể được quan sát trên Doppler màu (1, 3, 4, 5, 8).
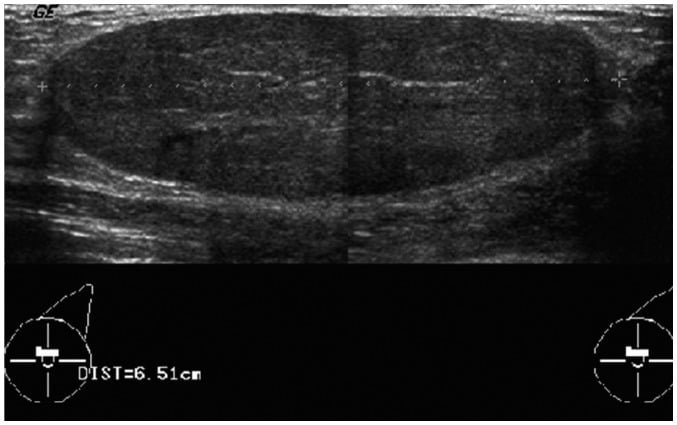
Hình 13. Bướu sợi tuyến khổng lồ ở cô gái 15 tuổi. Hình ảnh siêu âm cho thấy khối đồng âm, giới hạn rõ hình bầu dục, trục ngang, kích thước khoảng 6,5cm ở vú trái.
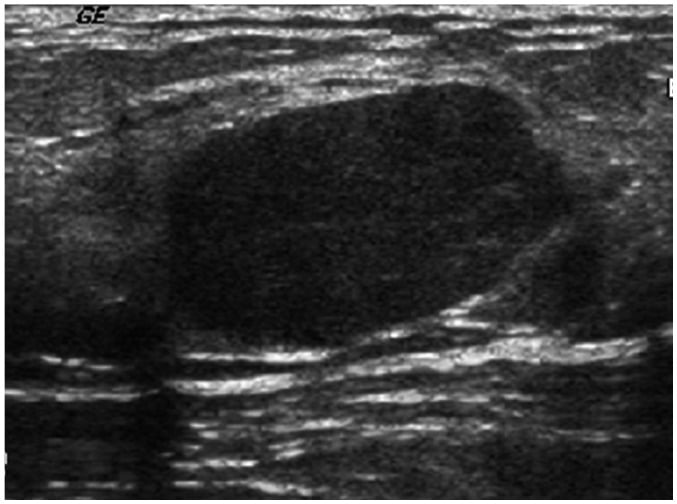
Hình 14. Bướu sợi tuyến thông thường ở cô gái 17 tuổi. Hình ảnh siêu âm cho thấy một khối hình bầu dục, giới hạn rõ, trục ngang, đồng âm với tăng âm sau ở vú trái.
Theo dõi trên siêu âm có thể được thực hiện đối với các bướu sợi tuyến có kích thước dưới 3cm có hình dạng điển hình trên hình ảnh và lâm sàng. Trong năm đầu tiên, siêu âm có thể được thực hiện 6 tháng một lần, trong hai năm tiếp siêu âm được thực hiện mỗi năm một lần để xác nhận sự ổn định của tổn thương. Đôi khi, bướu sợi tuyến cho thấy các đặc điểm không điển hình trên siêu âm, chẳng hạn như bờ góc cạnh hoặc bóng cản âm sau (5, 8). Nếu có các đặc điểm hình ảnh đáng ngờ với sự tăng trưởng hoặc có triệu chứng, sinh thiết hoặc phẫu thuật cắt bỏ nên được xem xét (1, 2, 5, 8, 23).
Chẩn đoán phân biệt bao gồm bướu diệp thể (phyllodes tumors) hoặc tăng sản mô đệm giả bướu mạch (pseudoangiomatous stromal hyperplasia), các thực thể này khó phân biệt trên siêu âm vì các đặc điểm hình ảnh tương tự của chúng (1, 2, 5, 7).
Tăng sản mô đệm giả bướu mạch là một bệnh hiếm gặp ở trẻ em và được đặc trưng bởi sự tăng sinh của các tế bào trung mô qua trung gian hormone có trong chất nền của mô vú và liên quan đến các bệnh lý vú khác. Tăng sản mô đệm giả bướu mạch đã được nhìn thấy ở phụ nữ tiền mãn kinh, nhưng hiếm khi được báo cáo ở trẻ em và thanh thiếu niên. Tăng sản mô đệm giả bướu mạch đã được báo cáo là có liên quan đến bệnh u sợi thần kinh loại 1 và tình trạng suy giảm miễn dịch. Khi tăng sản mô đệm giả bướu mạch trở thành một khối, các phát hiện lâm sàng và siêu âm của nó tương tự như các khối bướu sợi tuyến (Hình 15). Theo dõi trên siêu âm là đủ, mặc dù phẫu thuật được chỉ định cho các tổn thương kích thước lớn (1, 2, 7).
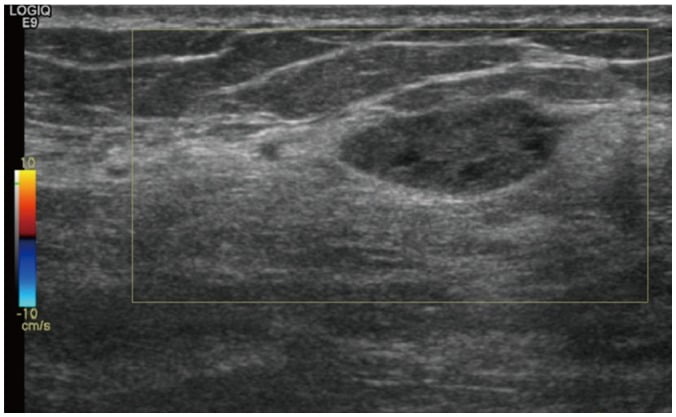
Hình 15. Tăng sản mô đệm giả bướu mạch (PASH, pseudoangiomatous stromal hyperplasia). Hình ảnh siêu âm ở phụ nữ 44 tuổi cho thấy khối hình bầu dục, giới hạn rõ, trục ngang và giảm âm với sự tăng cường âm sau ở vú phải. Các đặc điểm hình ảnh tương tự như bướu sợi tuyến (fibroadenoma). Sinh thiết lõi dưới hướng dẫn của siêu âm xác nhận là PASH.
Bệnh u nhú ở trẻ vị thành niên (juvenile papillomatosis) là một bệnh lành tính rất hiếm gặp. Nó cũng được gọi là bệnh phô mai Thụy Sĩ (Swiss cheese disease) và được đặc trưng bởi các khối sợi nhỏ với nhiều nang cục bộ và ống dẫn giãn (7, 24). Nó xảy ra ở tuổi vị thành niên muộn ở độ tuổi trung bình 19 tuổi và có thể liên quan đến các khối u vú lành tính tiềm ẩn. Trên lâm sàng, nó là một khối u cứng và di động không thể phân biệt với bướu sợi tuyến. Siêu âm có thể tạo điều kiện thuận lợi cho chẩn đoán bệnh u nhú ở tuổi vị thành niên biểu hiện bởi nhiều u nang nhỏ ngoại vi có giới hạn không xác định (Hình 16). Các đám vi vôi hóa có thể được nhìn thấy (2). Bệnh u nhú ở tuổi vị thành niên là một tổn thương mô học lành tính, nhưng có liên quan đến việc tăng nguy cơ ung thư vú. Khoảng 5-15% bệnh nhân bị ung thư vú và bị bệnh u nhú ở vị thành niên đồng thời, do đó việc theo dõi liên tục được đảm bảo. Tiền sử gia đình mắc bệnh ung thư vú, phát hiện mô bệnh học không điển hình, hai bên, đa tổn thương và sự tái phát có liên quan đến nguy cơ ác tính cao. Điều trị bao gồm cắt bỏ hoàn toàn, bởi vì tái phát có thể xảy ra nếu tổn thương được cắt bỏ một phần (1, 2, 7, 8, 25).
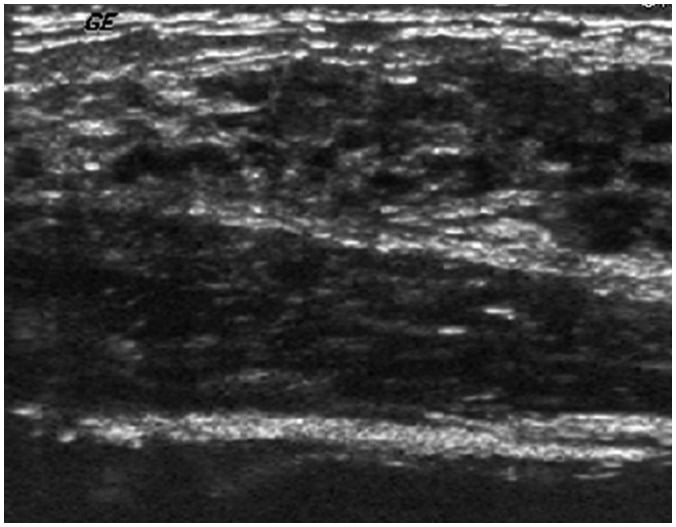
Hình 16. Bệnh nhân nữ 17 tuổi bị u nhú trẻ vị thành niên (juvenile papillomatosis) với tiết dịch ở núm vú. Hình ảnh siêu âm cho thấy ống dẫn sữa giống như pho mát Thụy Sĩ (Swiss cheese-like) ở vú phải. Phẫu thuật cắt bỏ xác nhận papillomatosis nội ống (intraductal papillomatosis)
8. Bướu diệp thể (Phyllodes tumor)
Bướu diệp thể là một dạng hiếm gặp của u nguyên bào sợi đòi hỏi cần phải phân biệt với bướu sợi tuyến. Về mặt mô học, bướu diệp thể được phân độ thành ba mức: thấp, trung bình và cao. Tất cả các loại mô học của chúng đều có thể tái phát nhưng hiếm khi di căn. Có một loại phụ ác tính rất hiếm của bướu diệp thể có các đặc điểm của sarcoma tế bào hình thoi mức độ thấp (low-grade spindle cell sarcoma) (1, 3, 4, 8, 26, 27) và thường gặp ở phụ nữ ở độ tuổi ba mươi. Nó chiếm ít hơn 1% các bệnh vú ở trẻ em, nhưng là khối u ác tính nguyên phát phổ biến nhất của tuổi thiếu niên (1, 3, 6, 26). Mặc dù 85% bướu diệp thể ở trẻ em và thanh thiếu niên là lành tính, tuy nhiên các trường hợp xâm lấn, di căn hoặc tái phát đã được báo cáo, với tỷ lệ tử vong khoảng 3% (1, 3, 6). Bướu diệp thể trên siêu âm không thể phân biệt với các bướu sợi tuyến. Bướu diệp thể điển hình là các khối đặc có giới hạn rõ, hình bầu dục và giảm âm (Hình 17). Một thành phần nang ngoại vi và các rãnh có thể được nhìn thấy thường xuyên hơn trong bướu diệp thể so với bướu sợi tuyến nhưng không phải là duy nhất đối với bướu diệp thể (1, 2, 3, 4, 8, 26) (Hình 18).
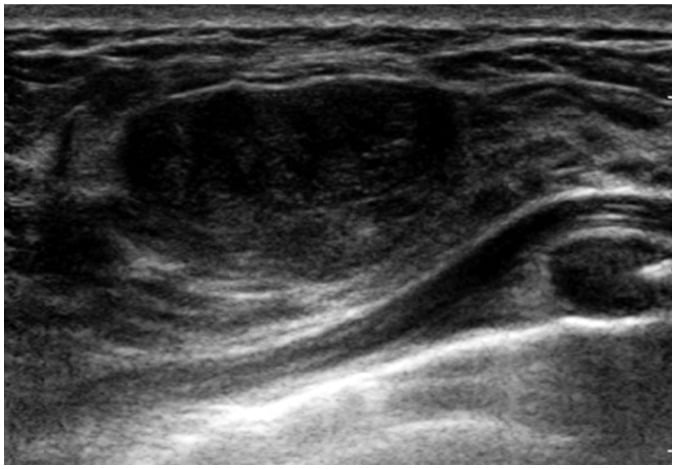
Hình 17. Bướu diệp thể ở cô gái 17 tuổi với một khối sờ thấy ở vú trái. Hình ảnh siêu âm cho thấy khối hình bầu dục, giới hạn rõ, kích thước 2,5 cm. Sinh thiết vú dùng thiết bị hỗ trợ hút chân không (vacuum-assisted biopsy) xác nhận bướu diệp thể lành tính.
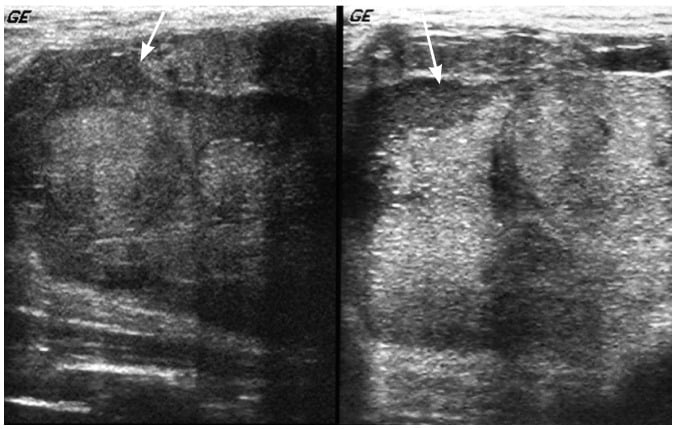
Hình 18. Bé gái 14 tuổi có một khối sờ thấy ở vú. Hình ảnh siêu âm cho thấy phần bên phải và trung tâm của khối. Có thể nhìn thấy khối lớn, giới hạn rõ, hình tròn với thành phần nang ở ngoại vi (mũi tên). Bệnh nhân được xác nhận có bướu diệp thể ác tính độ thấp (low-grade malignant phyllodes tumor).
Các đặc điểm siêu âm của bướu diệp thể tương tự như bướu sợi tuyến, và sinh thiết lõi có thể được sử dụng để phân biệt giữa khối này (8, 10, 23). Nếu khối u đã mở rộng nhanh hoặc các nang được nhìn thấy trong các khối u, sinh thiết lõi dưới hướng dẫn của siêu âm để được bảo đảm (1, 2, 4, 28). Nếu kích thước lớn hơn 5cm, phẫu thuật cắt bỏ được chỉ định, bởi vì khả năng sinh thiết lõi để phân biệt giữa bướu sợi tuyến và bướu diệp thể sẽ bị hạn chế (1, 2, 7, 8, 23). Nếu khối u được chẩn đoán là bướu diệp thể trên sinh thiết, phẫu thuật cắt bỏ rộng với giới hạn an toàn quanh 1-2 cm nên được thực hiện bất kể phân nhóm mô học nào. Tiên lượng nói chung là tốt. Tuy nhiên, tỷ lệ tái phát xảy ra ngay cả sau khi cắt bỏ hoàn toàn ít nhất là 20% các bướu diệp thể lành tính (7, 26). Di căn của bướu diệp thể là rất hiếm nhưng có thể xảy ra thông qua đường máu. Phổi là vị trí di căn thường gặp (7).
9. Các khối ác tính (Malignant masses)
Các khối vú ác tính (malignant breast masses) là khá hiếm ở trẻ em. Di căn hoặc bệnh máu ác tính (metastatic disease or hematologic malignancy) là nguyên nhân phổ biến gây ra ác khối u vú ác tính hơn so với ung thư biểu mô vú ở trẻ em và thanh thiếu niên (breast carcinoma in children and adolescents). Một khối u ác tính đôi khi có thể xảy ra ở một bệnh nhi là kết quả của bệnh ác tính về huyết học, thường là ung thư hạch (lymphoma) hoặc bệnh bạch cầu (leukemia), hoặc di căn từ ung thư cơ vân (rhabdomyosarcoma) hoặc u nguyên bào thần kinh (neuroblastoma). Bướu diệp thể ác tính là khối u ác tính nguyên phát phổ biến nhất ở trẻ em (1, 2, 3, 5, 6, 7, 8, 23).
Di căn đến vú cho thấy sự phổ biến của bệnh với tiên lượng xấu. Mặc dù nhiều tổn thương và hai bên gợi ý đến khối u ác tính di căn, bướu sợi tuyến lành tính cũng có thể xuất hiện dưới dạng tổn thương đa ổ và hai bên. Tuy nhiên, tổn thương đa ổ hoặc hai bên không phải là đặc điểm đặc trưng của tổn thương vú ác tính (8). Di căn vú được xem là khối không đều, không đồng nhất và giảm âm trên siêu âm. Chúng cũng có thể xuất hiện dưới nhiều hình thức khác nhau. Di căn vú ở bệnh nhân mắc bệnh bạch cầu hoặc ung thư hạch có thể được xem là khối đặc giới hạn rõ và giảm âm (2, 29). MRI rất hữu ích trong việc xác định nhiều tổn thương hoặc lan rộng. Mặc dù các đặc điểm MRI khác nhau của ung thư hạch hoặc bệnh bạch cầu đã được quan sát, ung thư hạch có thể cho thấy cường độ tín hiệu cao trên hình ảnh T2 với ngấm thuốc viền hoặc không đồng nhất và ngấm thuốc nhanh trên hình ảnh dynamic (Hình 19) (2, 29, 30). Điều quan trọng cần lưu ý là ung thư di căn của vú có các đặc điểm hình ảnh thay đổi, thường gợi ý tổn thương có lẽ là lành tính. Do đó, một bệnh nhân có bệnh ác tính ngoài vú đã biết biểu hiện có tổn thương vú nên được xem xét cẩn thận để sinh thiết vú ngay cả khi các đặc điểm hình ảnh có thể là lành tính (1, 2).
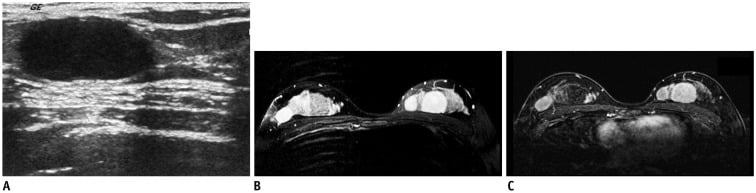
Hình 19. Cô gái 17 tuổi bị ung thư lympho Non-Hodgkin. (A) Siêu âm cho thấy nhiều khối hình bầu dục, giới hạn rõ, giảm âm với tăng âm sau ở cả hai vú. (B) MRI chuỗi xung T2W xóa mỡ cho thấy nhiều khối tròn, không đồng nhất với tín hiệu cao ở cả hai vú. (C) MRI T1W với kỹ thuật trừ giai đoạn sớm sau khi dùng thuốc tương phản gadolinium (early subtraction T1-weighted MR image after administration of gadolinium contrast) cho thấy khối ở vú hai bên ngấm thuốc không đồng nhất. Sinh thiết lõi cho thấy u nguyên bào lympho tế bào B di căn của vú (metastatic lymphoblastic B-cell lymphoma of breast).
Ung thư vú nguyên phát (primary breast cancer) là cực kỳ hiếm ở trẻ em và thanh thiếu niên. Tỷ lệ mắc ung thư vú là 1 trên 1000000 ở phụ nữ dưới 20 tuổi, nhưng cao hơn đáng kể ở phụ nữ trên 25 tuổi (1, 2, 6, 31). Loại mô học phụ (histologic subtype) phổ biến nhất của ung thư vú nguyên phát trong thời thơ ấu là ung thư biểu mô tuyến vú, có tiên lượng tương đối khả quan (32, 33). Chiếu xạ vào thành ngực là một yếu tố nguy cơ chính. Hơn nữa, nguy cơ ung thư vú đã được báo cáo là tăng gấp 75 lần khi một bệnh nhân ở độ tuổi 10-16 được điều trị bằng xạ trị cho bệnh Hodgkin (7, 8). Các yếu tố nguy cơ gây ung thư vú bao gồm đột biến gen như BRCA1 hoặc BRCA2 (1, 2, 8). Ung thư vú nguyên phát có hình dạng không đều với bờ không rõ, trục dọc, giảm âm không đồng nhất, bóng cản âm sau và tăng tưới máu trên siêu âm (Hình 20). Các đặc điểm liên quan, chẳng hạn như biến dạng cấu trúc (architectural distortion), biến đổi ống dẫn (ductal changes) và hạch nách (ipsilateral axillary lymphadenopathy) cũng có thể làm tăng sự nghi ngờ của bệnh ác tính (7). Vi vôi hóa nhỏ đa hình (fine pleomorphic) hoặc vôi hóa nhỏ dạng đường phân nhánh (fine linear branching morphology) hoặc vôi hóa phân bố theo nhóm hoặc theo thùy (grouped or segmental distribution) trên nhũ ảnh là những phát hiện rất đáng nghi ngờ. Tuy nhiên, chụp nhũ ảnh không được thực hiện thường xuyên ở trẻ em và có giá trị chẩn đoán hạn chế. Các đặc điểm hình ảnh của ung thư vú ở bệnh nhân đột biến BRCA1 tương tự như các tổn thương lành tính như bướu sợi tuyến, vì vậy cần xem xét bao gồm cả đặc điểm lâm sàng và hình ảnh trong quản lý (34, 35). Phẫu thuật bảo tồn vú là khả thi, mặc dù không có sự đồng thuận. Cho rằng 20-30% trường hợp có di căn ở nách, lấy hạch gác (sentinel lymph node sampling) được ủng hộ (1, 7, 8).
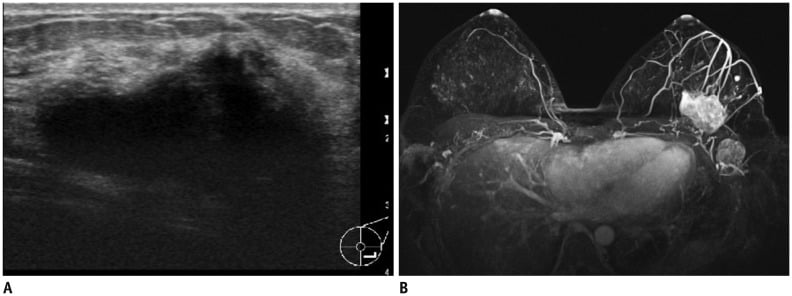
Hình 20. Ung thư vú nguyên phát ở phụ nữ 23 tuổi có tiền sử gia đình mắc bệnh ung thư vú. (A) Hình ảnh siêu âm vú cho thấy một khối không đều, giới hạn không rõ, giảm âm với bóng lưng sau. (B) MRI kỹ thuật trừ sớm sau tiêm thuốc tương phản tái tạo MIP cho thấy khối ngấm thuốc nhanh với các cấu trúc mạch máu tân sinh. Hạch nách phì đại ngấm thuốc cũng được ghi nhận ở nách trái (level I). Sinh thiết lõi dưới hướng dẫn của siêu âm xác nhận ung thư biểu mô ống xâm lấn (invasive ductal carcinoma).
10. Quản lý bệnh vú ở trẻ em và thanh thiếu niên (Management of breast diseases in children and adolescents)
Bệnh vú ở trẻ em và thanh thiếu niên khác với ở người lớn. Đánh giá kết quả chẩn đoán hình ảnh dựa trên Hệ thống dữ liệu và báo cáo hình ảnh vú (BIRADS) (36) không được sử dụng phổ biến ở bệnh nhi (1, 5, 8) vì mục đích của nó là phân loại bệnh theo khả năng ác tính, đó là cực kỳ hiếm ở trẻ em. Phần lớn các tổn thương vú ở trẻ em có thể được phân loại thành BIRADS 2 (lành tính) hoặc BIRADS 3 (có thể là lành tính) với một khuyến nghị về theo dõi hình ảnh trong một khoảng thời gian. Bướu sợi tuyến là khối u vú phổ biến nhất ở trẻ em và thanh thiếu niên. Nó thường được xem là một khối u có thể lành tính với phân loại BIRADS 3 và có khả năng ác tính dưới 2%. Nếu kết quả lâm sàng và siêu âm là lành tính, giải thích cho bệnh nhân và người nhà là tất cả những gì cần thiết. Theo dõi bằng các phương pháp bảo tồn như siêu âm được khuyến nghị (5, 8, 23). Nói chung, siêu âm theo dõi được thực hiện theo chu kỳ 6 tháng trong năm đầu tiên và sau 12 tháng cuối năm thứ hai. Trong bệnh vú ở trẻ em, kích thước và sự tăng trưởng của khối cũng có thể ảnh hưởng đến việc quản lý (1, 5, 8, 10, 23, 37).
Phẫu thuật cắt bỏ được đề xuất cho các khối có các đặc điểm lành tính trên siêu âm lớn hơn 5cm hoặc phát triển nhanh chóng (5, 8). Gordon và cộng sự (37) đã đề nghị cắt bỏ khối tăng kích thước hơn 20% trong 6 tháng hoặc lớn hơn 3cm để phân biệt với bướu diệp thể. Tuy nhiên, phẫu thuật xâm lấn có thể làm hỏng mô vú đang phát triển bình thường và bướu diệp thể không điển hình là hiếm ở trẻ em. Nhiều bướu diệp thể tương tự như bướu sợi tuyến. Sinh thiết lõi thay vì phẫu thuật được khuyến khích (8, 10, 23). Sanders và cộng sự (23) đã chỉ ra 1% bướu diệp thể có kích thước đo được bằng 3cm hoặc ít 3cm, 6% có kích thước ở 3-5cm, cho thấy rằng 3cm có thể được sử dụng làm tiêu chí để sinh thiết lõi. Cắt bỏ được đề nghị cho khối lớn hơn 5cm. Mặc dù hầu hết các tổn thương vú ở trẻ em là lành tính, bệnh ác tính là có thể. Kiểm tra mô học được xem xét dựa trên các đặc điểm lâm sàng, tiền sử, yếu tố gia đình và đặc điểm siêu âm (1, 5, 6). Sinh thiết hoặc can thiệp phẫu thuật được chỉ định. Ngay cả khi các đặc điểm hình ảnh là lành tính ở bệnh nhân có tiền sử lâm sàng nguy cơ cao, chẳng hạn như tiền sử bệnh ác tính khác, tiền sử gia đình bị ung thư vú, chiếu xạ ngực trước đó hoặc đột biến gen, sinh thiết nên được xem xét cẩn thận (Hình 21) (1, 3, 8). Sinh thiết lõi có độ chính xác cao ở trẻ em, đặc biệt là trong việc phân biệt bướu sợi tuyến và bướu diệp thể. Phẫu thuật cắt bỏ được chỉ định trong trường hợp lấy mẫu mô không đầy đủ hoặc khó chẩn đoán với sinh thiết bằng kim (1, 23). Một vài thực thể lành tính, bao gồm các tổn thương liên quan đến chấn thương và nhiễm trùng (trauma-related lesions and infection), có thể biểu hiện như những đặc điểm ác tính đáng ngờ, và đánh giá chi tiết về bệnh sử là rất quan trọng trước khi tiến hành can thiệp kịp thời (Hình 22).
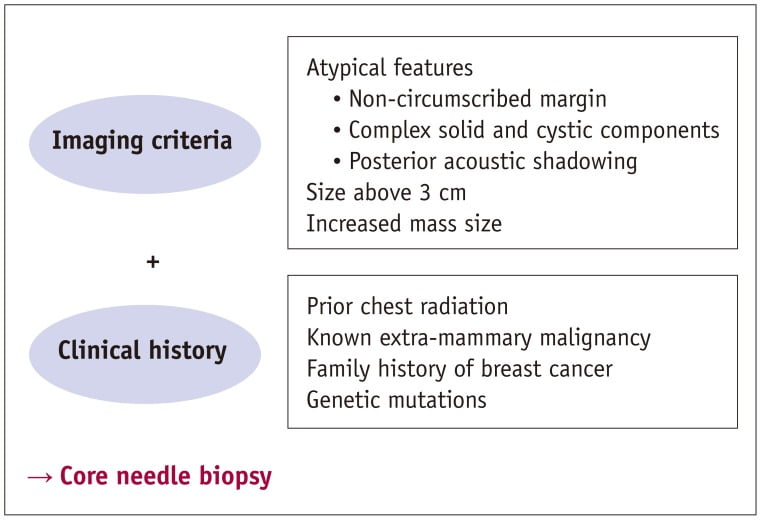
Hình 21. Tóm lược về quản lý bệnh lý vú trẻ em.
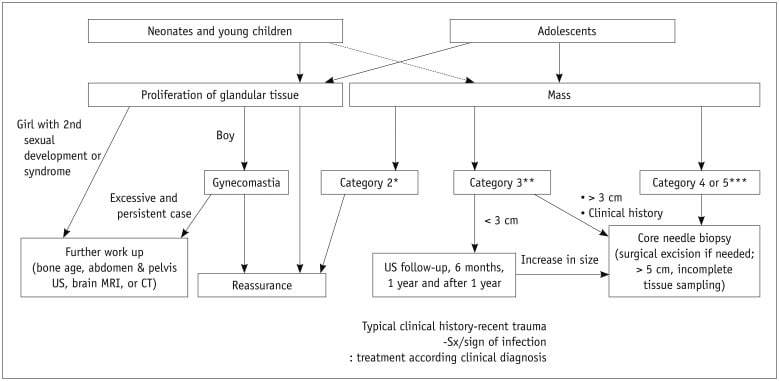
Hình 22. Thuật toán siêu âm đánh giá và quản lý các tổn thương vú trẻ em.
* BIRADS 2: nang đơn giản. Khối hình tròn, hình bầu dục, giới hạn rõ, không có hồi âm với tăng âm sau.
** BIRADS loại 3: Khối hình bầu dục, hình tròn, giảm âm hoặc đồng âm hoặc tăng âm với tình trạng mạch máu thay đổi.
*** BIRADS 4 hoặc 5: Các khối với các đặc điểm nghi ngờ; bờ không đều, trục dọc, giới hạn không rõ, tăng sinh mạch, hồi âm không đồng nhất (bao gồm cả thành phần nang phức hợp và đặc), và các đặc điểm liên quan.
BIRADS = Hệ thống dữ liệu và báo cáo hình ảnh vú, Sx/sign = triệu chứng/dấu hiệu.
11. Kết luận (Conclusion)
Chẩn đoán và quản lý các bệnh vú ở trẻ em và thanh thiếu niên khác với ở người lớn. Hầu hết các tổn thương vú ở trẻ em và thanh thiếu niên có liên quan đến sự phát triển vú hoặc là khối u lành tính. Do đó, quản lý của họ nên được bảo tồn. Siêu âm là một phương thức hình ảnh đầu tiên cần thiết ở trẻ em. Nhiều khối u lành tính xuất hiện tương tự nhau và thường phải theo dõi bằng siêu âm. Khối u ác tính ở bệnh nhi rất hiếm. Kiểm tra mô học cẩn thận được khuyến cáo bằng cách kết hợp diễn tiến lâm sàng, kích thước khối, tốc độ tăng trưởng và đặc điểm siêu âm ở trẻ em. Sinh thiết lõi là một kỹ thuật hữu ích có thể cung cấp một chẩn đoán chính xác mà không gây ra thiệt hại không thể khắc phục ở trẻ em.
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PMC free article] [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PMC free article] [PubMed] [Google Scholar]
[PMC free article] [PubMed] [Google Scholar]
[PMC free article] [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[PubMed] [Google Scholar]
[Google Scholar]
[PubMed] [Google Scholar]
Đang cập nhật…