Bs. Hoàng Văn Trung
Bài viết này xin giới thiệu một các cơ bản về giải phẫu và các bệnh lý cột sống thắt lưng, chủ yếu liên quan đến hẹp ống sống.
Mục lục:
I. Đặc điểm giải phẫu và chức năng cột sống thắt lưng
1. Đặc điểm chung của cột sống và cột sống thắt lưng
2. Cấu tạo ống sống thắt lưng
3. Các thành phần giải phẫu liên quan đến ống sống thắt lưng
3.1. Cấu trúc của đốt sống thắt lưng
3.2. Đặc điểm đĩa đệm cột sống thắt lưng
3.3. Lỗ liên hợp
3.4. Các dây chằng
3.5. Các màng tủy
3.6. Liên quan giữa rễ thần kinh với đĩa đệm và thân đốt sống
3.7. Nón tủy, chóp cùng và đuôi ngựa
II. Sự hình thành và phát triển của cột sống
1. Sự hình thành tủy gai và ống sống
2. Quá trình phát triển
III. Nguyên nhân hẹp ống sống thắt lưng
1. Hẹp ống sống bẩm sinh
2. Hẹp ống sống mắc phải
3. Nguyên nhân hỗn hợp
IV. Triệu chứng lâm sàng và xét nghiệm sinh hóa
1. Các yếu tố giúp chẩn đoán vị trí tổn thương
1.1. Sơ đồ cảm giác cơ thể
1.2. Các phản xạ
1.3. Các khoanh cơ
2. Triệu chứng lâm sàng
2.1. Hội chứng cột sống
2.2. Hội chứng rễ thần kinh
3. Xét nghiệm dịch não tủy
V. Thoát vị đĩa đệm
1. Phân loại các kiểu thoát vị đĩa đệm
2. Phân độ chèn rễ thần kinh, ghi nhận theo phân độ của Pfirrmann
VI. Chẩn đoán hình ảnh hội chứng hẹp ống sống thắt lưng
1. Chụp Xquang quy ước
2. Chụp tủy bơm cản quang
3. Chụp cắt lớp vi tính
4. Chụp cộng hưởng từ cột sống
5. Chẩn đoán hẹp ống sống
5.1. Khái quát
5.2. Tiêu chuẩn trên Xquang
5.3. Tiêu chuẩn trên cộng hưởng từ
VII. Điều trị
1. Điều trị bảo tồn
2. Điều trị phẫu thuật
3. Điều trị phục hồi chức năng
VIII. Tài liệu tham khảo
———————————————————————————————-
I. Đặc điểm giải phẫu và chức năng cột sống thắt lưng
1. Đặc điểm chung của cột sống và cột sống thắt lưng
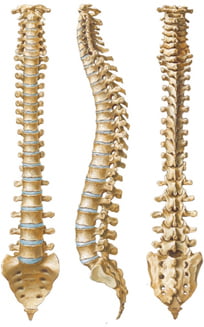
Cột sống con người có từ 33 đến 35 đốt sống xếp chồng lên nhau, gồm có: 7 đốt sống cổ, 12 đốt sống ngực, 5 đốt sống thắt lưng, 5 đốt tiếp theo dính lại làm một tạo thành xương cùng và 4 đến 6 đốt cuối cùng rất nhỏ và cằn cỗi cũng dính lại tạo thành xương cụt. Nhìn nghiêng cột sống có bốn đoạn cong, đoạn cổ lồi ra trước, đoạn ngực lồi ra sau, đoạn thắt lưng lồi ra trước và đoạn cùng lồi ra sau [12]. Đường cong sinh lý cột sống của đoạn thắt lưng là do các đốt sống thắt lưng sắp xếp lại tạo nên một đường cong đều đặn và liên tục.
Vùng thắt lưng là vùng gánh chịu sức nặng của cơ thể. Để đảm bảo chức năng đó, các cơ và dây chằng được cấu tạo rất khỏe, đốt sống và đĩa đệm có kích thước lớn hơn các vùng khác, nhất là đốt sống L4, L5. Đây còn là đoạn cột sống có tầm hoạt động rất lớn với các động tác gấp, duỗi, nghiêng, xoay có biên độ rộng. Đó là nhờ đĩa đệm ở đây có cấu tạo bởi vòng sợi, mâm sụn, nhân nhầy có tính chất chịu lực đàn hồi và linh hoạt giúp cho cột sống có khả năng chịu được các lực tác động khi cơ thể hoạt động [10].
2. Cấu tạo ống sống thắt lưng
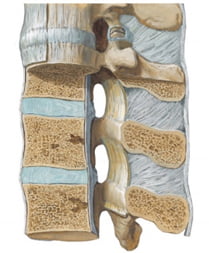
Ống sống thắt lưng được giới hạn phía trước bởi thân đốt sống và các đĩa đệm, phía sau bởi dây chằng vàng và các cung đốt sống, bên cạnh là các cuống, vòng cung và lỗ liên hợp. Trong ống sống thắt lưng có bao màng cứng, rễ thần kinh và tổ chức quanh màng cứng (tĩnh mạch, động mạch, tổ chức mỡ…). Vì vậy các rễ thần kinh không bị chèn ép bởi các thành phần xương của ống sống, kể cả khi vận động cột sống tới biên độ tối đa. Bình thường, lỗ ống sống ở L1, L2 có hình ba cạnh và khá cao (14-22mm), ở đoạn L3-L5 có hình năm cạnh (13-20mm) [10].
Hình 2. Ống sống thắt lưng [59].
3. Các thành phần giải phẫu liên quan đến ống sống thắt lưng
3.1. Cấu trúc của đốt sống thắt lưng
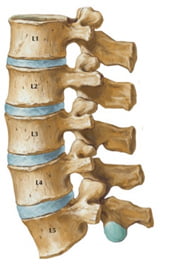
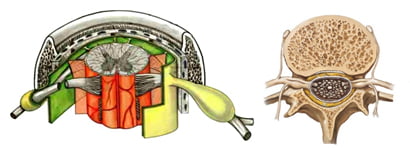
Cột sống thắt lưng gồm năm đốt sống, đoạn này cong ra trước và di dộng nhiều. Mỗi đốt sống gồm có cung trước và cung sau bao quanh ống sống. Cấu tạo của các đốt sống ở đoạn thắt lưng có đặc điểm khác với các đốt sống ở các vùng khác, giúp cho cột sống chịu được áp lực trọng tải lớn và thường xuyên theo trục dọc của cơ thể [12].

Hình 3. Đốt sống thắt lưng [59].
3.2. Đặc điểm đĩa đệm cột sống thắt lưng
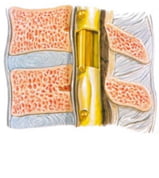
Đoạn cột sống thắt lưng có bốn đĩa đệm và hai đĩa đệm chuyển đoạn vùng bản lề (ngực-thắt lưng và thắt lưng-cùng). Các đĩa đệm thắt lưng chiếm 33.3% tổng chiều dài đĩa đệm cột sống, kích thước của các đĩa đệm càng ở dưới càng lớn. Do độ ưỡn của cột sống thắt lưng nên chiều cao đĩa đệm ở phía trước dày hơn phía sau.
Ở khoang gian đốt thắt lưng, sự chênh lệch chiều cao giữa phía trước và phía sau là lớn nhất nên đĩa đệm này có hình thang ở bình diện đứng dọc.
Đĩa đệm có hình thấu kính lồi hai mặt gồm: nhân nhầy, mâm sụn và vòng sợi.
– Nhân nhầy đĩa đệm nằm ở khoảng nối 1/3 giữa và 1/3 sau của đĩa đệm, được cấu tạo bởi một vỏ liên kết bên ngoài và nhân là mucoprotein.
– Mâm sụn: bao phủ phần trung tâm của mặt trên và mặt dưới thân đốt sống, phía trước và hai bên được vành xương ngoại vi vây quanh, phía sau trải ra đến mép của thân đốt sống.
– Vòng sợi được cấu tạo bằng những sợi rất chắc nhưng lại có tính đàn hồi. Các sợi đan ngược lấy nhau theo kiểu xoắn ốc, xếp thành từng lớp đồng tâm chạy nghiêng từ thân đốt sống này đến thân đốt sống kế cận. Tại vùng riềm của vòng sợi, một dải sợi tăng cường (sợi Sharpey) móc chặt vòng sợi vào riềm xương.

Hình 4. Cấu trúc đĩa đệm [59].
Phần sau và phần bên của vòng sợi mỏng hơn so với ở các chỗ khác, đây là điểm yếu nhất của vòng sợi. Thêm vào đó, dây chằng dọc trước chắc và rất rộng ở vùng lưng, nó bao quanh các cấu trúc đĩa đệm và phần trước của đốt sống. Vì những lý do trên, thoát vị đĩa đệm thường xảy ra ở phía sau nhiều hơn phía trước [10].
Hình 5. Cấu trúc đĩa đệm và thân sống [59].
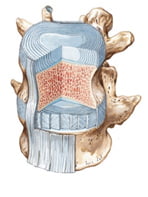
3.3. Lỗ liên hợp
Lỗ liên hợp được tạo thành bởi khuyết sống trên và khuyết sống dưới, giới hạn phía trước bởi thân đốt sống và đĩa đệm, ở phía trên và dưới là các cuống cung đốt sống và phía sau là các diện khớp của các khớp nhỏ đốt sống. Các lỗ liên hợp thường nằm ngang mức với đĩa đệm. Lỗ liên hợp có các dây thần kinh sống chạy qua, đường kính của các rễ thần kinh tủy sống vùng thắt lưng lớn dần từ trên xuống dưới và lớn nhất ở L5. Các tư thế ưỡn và nghiêng lưng sẽ làm giảm đường kính lỗ liên hợp khi đĩa đệm bị lồi, thoát vị về phía bên sẽ làm hẹp lỗ liên hợp, chèn ép thần kinh tủy sống gây đau [10].
Hình 6. Cấu tạo lỗ liên hợp, đoạn CSTL nhìn bên thấy được lỗ liên hợp [59].
3.4. Các dây chằng
Dây chằng dọc trước: Phủ mặt trước thân đốt sống và phần bụng của đĩa đệm từ đốt sống cổ C1 đến xương cùng [10].
Dây chằng dọc sau: Nằm ở mặt sau của thân đốt sống từ đốt cổ C2 đến xương cùng, rộng hơn ở phía trên, khi chạy tới đoạn thắt lưng dây chằng này chỉ còn là một dải nhỏ, không hoàn toàn phủ kín giới hạn sau của đĩa đệm. Như vậy phần sau bên của đĩa đệm được tự do cho nên thoát vị đĩa đệm thường xảy ra nhiều nhất ở đó [10].
Dây chằng vàng: Phủ phần sau của ống sống và bám từ cung đốt này đến cung đốt khác và tạo nên một bức vách thẳng ở phía sau ống sống để bảo vệ tủy sống và các rễ thần kinh. Chiều dày của dây chằng vàng tăng dần từ trên xuống dưới. Dây chằng vàng có tính đàn hồi, nó góp phần kéo cột sống trở về nguyên vị trí sau khi cử động. Sự phì đại của dây chằng vàng cũng là một nguyên nhân gây đau kiểu rễ vùng thắt lưng [10].
Các dây chằng khác: Dây chằng bao khớp bao quanh giữa khớp trên và dưới của hai đốt sống kế cận. Dây chằng trên gai và dây chằng liên gai có chức năng liên kết các mỏm gai với nhau [10], [47].
Hình 7. Dây chằng cột sống [59].
3.5. Các màng tủy
Màng tủy bao xung quanh, có chức năng bảo vệ, nuôi dưỡng và nâng đỡ tủy sống. Màng tủy có cấu tạo gồm ba lớp là màng cứng, màng nhện và màng mềm [8].
Hình 8. Cấu tạo của màng tủy [59], [65].
Màng cứng là một tổ chức sợi dai chắc, tạo thành một túi hình trụ bao quanh trục thần kinh, tận cùng hình thành chóp ở đốt cùng thứ hai. Mặt ngoài của màng cứng được ngăn cách với cột sống bởi khoang ngoài màng cứng có chứa những đám rối tĩnh mạch và mỡ.
Màng nhện là một tổ chức liên kết gồm hai lá cách nhau một khoang ảo, lá ngoài dính vào mặt trong của màng cứng, giữa màng nhện và màng mềm phía trong là khoang dưới nhện chứa dịch não tủy.
Màng mềm dính sát vào bề mặt của tủy và chứa nhiều mạch máu [12].
3.6. Liên quan giữa rễ thần kinh với đĩa đệm và thân đốt sống
Tủy sống dừng ở ngang mức đốt sống thắt lưng L1 hoặc L2, nhưng các rễ thần kinh vẫn tiếp tục chạy xuống dưới và rời ống sống qua lỗ liên hợp tương ứng, như vậy rễ thần kinh phải đi một đoạn dài trong khoang dưới nhện.
Hướng đi của các rễ thần kinh sau khi chúng ra khỏi bao màng cứng tuỳ thuộc vào chiều cao đoạn tương ứng.
Rễ L4 tách ra khỏi bao màng cứng chạy chếch xuống dưới và ra ngoài thành một góc 60o, rễ L5 tạo góc 45o và rễ S1 tạo góc 30o [10].
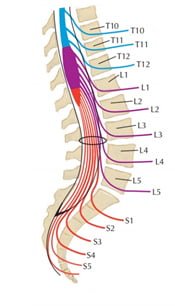
Hình 9. Liên quan rễ TK và đốt sống [59].
Do đó, ở đoạn vận động cột sống thắt lưng, liên quan định khu không tương ứng giữa đĩa đệm và rễ thần kinh, cụ thể là:
Rễ L3 thoát ra khỏi bao màng cứng ở độ cao của đốt L2.
Rễ L4 thoát ra khỏi bao màng cứng ở độ cao của đốt L3.
Rễ L5 thoát ra ở bờ dưới thân đốt L4.
Rễ S1 thoát ra ở bờ dưới thân đốt L5 [10].
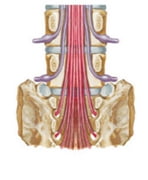
Hình 10. Liên quan rễ TK và đĩa đệm [59].
Các rễ thần kinh đoạn cột sống thắt lưng lớn dần từ trên xuống, rễ L5 có đường kính lớn nhất, tỷ lệ đường kính của L1 so với L5 là 1/5, nhưng ở lỗ liên hợp L5-S1, khoang rỗng tự do dành cho rễ L5 hoạt động lại rất nhỏ.
Rễ thần kinh còn có liên quan trực tiếp đến độ rộng của ống sống nên hẹp ống sống sẽ gây cho rễ thần kinh dễ bị chèn ép.
3.7. Nón tủy, chóp cùng và đuôi ngựa
– Hình thể ngoài:
Nón tủy là phần dưới của tủy sống, nó tương ứng với đoạn thắt lưng 1 hoặc thắt lưng 2. Chóp cùng tủy là phần cuối cùng của tủy sống, dài khoảng 2cm được tiếp nối với xương cụt bởi dây cùng. Đuôi ngựa được hình thành từ nón tủy cho ra các rễ thần kinh sống, đi vượt qua chóp cùng, bao gồm các đôi rễ thần kinh thắt lưng 2, 3, 4, 5, năm đôi rễ cùng và một đôi dây cụt. Các rễ đi thẳng xuống túi cùng của màng cứng và tách ra ở từng tầng tại đó. Các rễ được ngâm trong dịch não tủy ở khoang dưới nhện nằm trong túi cùng màng cứng mà tận cùng ngang mức đốt sống cùng thứ 2 [1], [12].
Chóp cùng tủy được nuôi dưỡng bởi ba động mạch chính: Động mạch gai trước và hai động mạch bên sau, ba động mạch này tụ lại ở chóp cùng và tạo thành quai mạch nối ở chóp cùng. Ngoài ra cũng có nguồn cung cấp máu nữa là nhánh động mạch rễ bắt nguồn từ động mạch chủ qua trung gian động mạch thắt lưng, các mạch cùng và mạch chậu thắt lưng. Theo một số tác giả chóp cùng không có động mạch rễ, tuy nhiên theo Deproz-Gotteron có 4% trường hợp có một động mạch rễ đi theo rễ L5 (động mạch Deproz-Gotteron). Khi có tác nhân chèn ép vào tủy hoặc do bất thường bản thân mạch máu sẽ gây thiếu máu cục bộ vùng tủy tương ứng. Các rễ thần kinh còn được nuôi dưỡng bởi sự khuếch tán từ dịch não tủy bao bọc xung quanh [1].
Nón tủy và chóp cùng là phần cuối cùng của tủy sống và xung quanh là các rễ thần kinh, do vậy khi tổn thương vùng này thường phối hợp các dấu hiệu và triệu chứng của tế bào vận động trên và tế bào vận động dưới. Tổn thương đuôi ngựa là tổn thương tế bào vận động dưới với các rễ thần kinh là thành phần của hệ thần kinh ngoại biên [1], [12].
– Hình thể trong:
Tủy sống gồm ba phần: Ống trung tâm, chất xám ở trung tâm và chất trắng ở ngoại vi, tỉ lệ giữa chất xám và chất trắng của tủy sống thay đổi tuỳ từng vùng của tủy, ở vùng nón tủy tỉ lệ này là lớn nhất [12].
Đuôi ngựa: Các rễ thần kinh đuôi ngựa mang sợi cảm giác của chi dưới, da vùng đáy chậu và sợi vận động chi dưới. Các rễ thần kinh cùng mang các sợi cảm giác, vận động, phó giao cảm chi phối hoạt động tiểu tiện, đại tiện và cương dương [1].
II. Sự hình thành và phát triển của cột sống
1. Sự hình thành tủy gai và ống sống
Hệ thần kinh có nguồn gốc ngoại bì phôi, đầu tiên chỉ là tấm thần kinh ở mặt lưng phôi, sau đó lõm dần hai bờ thành máng thần kinh và cuối cùng hàn khép lại hai mép hoàn toàn tạo thành ống thần kinh, đây chính là trục não-tủy sống. Phần đầu ống phát triển rất to thành não, phần đuôi dài hẹp và ít thay đổi hơn phát triển thành tủy gai.
Tủy gai dần tách khỏi lớp ngoại bì và chui vào sâu, ở sau các cung đốt sống, các cung này có nguồn gốc từ trung bì phôi. Các cung đốt sống sẽ phát triển dần dần ra sau, quặp lại, dính với nhau trên đường giữa tạo thành mỏm gai thì tủy gai nằm lọt trong ống sống [12].
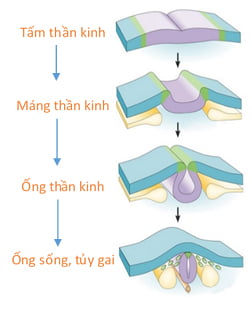
Hình 11. Sự hình thành ống sống và tủy gai [34].
2. Quá trình phát triển
Tủy gai bắt đầu từ bờ trên đốt sống cổ C1, nơi liên tục với hành não và tận cùng ở bờ dưới đốt sống thắt lưng L1 hay bờ trên đốt sống thắt lưng L2. Trong 2 tháng đầu của thai nhi, tủy gai chiếm trọn chiều dài của ống sống. Nhưng càng về sau do tốc độ phát triển của cột sống nhanh hơn nên tủy gai mới ở vị trí cao như vậy. Điều này giải thích tại sao các dây thần kinh gai sống của các phần tủy cuối phải đi xuống một khoảng dài trong ống sống tạo thành đuôi ngựa, trước khi thoát ra ngoài qua lỗ gian đốt sống [12].
III. Nguyên nhân hẹp ống sống thắt lưng
Hẹp ống sống là sự giảm kích thước của ống sống gây chèn ép tủy sống và rễ thần kinh. Có thể do sự thu hẹp của ống sống trung tâm, hẹp ngách bên, hẹp kênh ra rễ thần kinh gây ra các triệu chứng lâm sàng [57]. Nguyên nhân gây hẹp ống sống có thể do là hẹp ống sống bẩm sinh, hẹp ống sống mắc phải hoặc phối hợp [35], [50].
1. Hẹp ống sống bẩm sinh
Định nghĩa hẹp ống sống nguyên nhân bẩm sinh đơn thuần:
– Hẹp ống sống bẩm sinh thường xảy ra ở độ tuổi sớm hơn so với hẹp ống sống mắc phải. Triệu chứng lâm sàng cũng tương tự như hội chứng hẹp ống sống mắc phải như đau lưng, đi khập khiễng cách hồi và đau kiểu rễ. Bệnh nhân hẹp ống sống bẩm sinh có xu hướng đau lưng thấp phổ biến hơn một chút so với bệnh nhân hẹp ống sống mắc phải, khoảng 80%, và đau lưng thấp có xu hướng là triệu chứng khó chịu nhất.
– Chẩn đoán hình ảnh cho thấy hẹp ống sống bẩm sinh có xu hướng gặp ở người trẻ, ít biểu hiện của thoái hóa và xảy ra ở nhiều tầng đốt sống. Tiêu chuẩn chẩn đoán là giá trị trung bình của tỷ số giữa độ rộng của cuống sống và đường kính trước sau của thân đốt sống ngang mức L3 nhỏ hơn 0.36 trên CHT mặt phẳng Sagittal và nhỏ hơn 0.43 trên XQ tư thế nghiêng [58].
Nguyên nhân:
– Bệnh loạn sản sụn.
– Hẹp ống sống nguyên phát:
Đường kính trước sau bị giảm.
Khoảng cách liên cuống bị ngắn.
Ngách bên của ống sống bị san phẳng.
– Dị dạng đốt sống: có thể dị dạng toàn bộ cột sống thắt lưng hoặc chỉ dị dạng một đốt sống thắt lưng, có thể hẹp nhiều hay ít hoặc chỉ hẹp ở ngách bên.
– Quá ưỡn cột sống thắt lưng.
– Dị dạng các bản và cuống cung sau.
2. Hẹp ống sống mắc phải
– Biến đổi thoái hóa: thoái hóa cột sống, lồi đĩa đệm, vôi hóa phì đại dây chằng vàng, vôi hóa phì đại dây chằng dọc sau, phì đại dây chằng vòng.
– Trượt đốt sống.
– Phản ứng xương ở các cạnh và khớp đốt sống.
– Phì đại các khối khớp.
– Thoát vị đĩa đệm.
– Hẹp ống sống sau phẫu thuật: sau phẫu thuật cố định cột sống, tổ chức sẹo.
– Hư khớp: thường gặp ở các khối khớp sau.
– Do các gai xương ở các mỏm khớp trên và dưới của đốt sống.
– Hẹp ống sống sau chấn thương [47].
– Bệnh toàn thân: nhiễm độc Fluor, bệnh Paget.
– Các cấu trúc bất thường như: khối u, viêm, áp xe, dị vật, dị dạng mạch máu, khối máu tụ [1], [8]…
3. Nguyên nhân hỗn hợp
Thường gặp hẹp ống sống nguyên phát kết hợp với biến đổi thoái hóa [1].
IV. Triệu chứng lâm sàng và xét nghiệm sinh hóa
1. Các yếu tố giúp chẩn đoán vị trí tổn thương
1.1. Sơ đồ cảm giác cơ thể
– Khái niệm về các “khoanh da” và sơ đồ cảm giác của cơ thể: Có thể coi tủy sống là sự chồng lên nhau của các đốt tủy, mỗi một đốt tủy cho ra mỗi bên một đôi rễ thần kinh. Các rễ này liên quan đến một vùng da mà chúng tiếp nhận kích thích cảm giác, đó là vùng cảm giác ngoài da (khoanh da). Có thể dựa vào sơ đồ cảm giác da để chẩn đoán vị trí tổn thương.
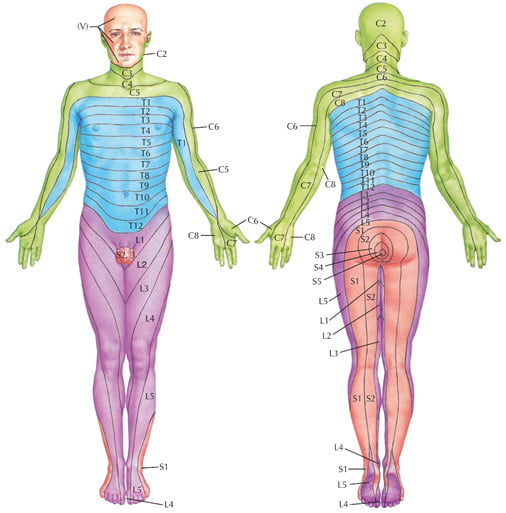
Hình 12. Phân vùng cảm giác da trên cơ thể. Ranh giới sơ đồ của các đốt da biểu diễn như những đoạn riêng biệt, nhưng thực ra có sự chồng chéo giữa 2 vùng lân cận (V: thần kinh sinh ba, C: Rễ TK ở cổ, T: Rễ TK ngực, L: Rễ TK thắt lưng, S: Rễ TK cùng) [59].
– Đau kiểu rễ: Mỗi một khu vực da thường được chi phối bởi ba rễ thần kinh kế tiếp, trong đó có một rễ chính. Là kiểu đau theo đường đi của thần kinh chi phối. Loại đau kiểu rễ thường gặp nhất là đau rễ thắt lưng cùng L5 và S1, ít gặp hơn là rễ L3, L4. Đau tăng khi vận động thắt lưng hoặc tăng áp lực ổ bụng. Nếu rễ L5 bị chèn ép thì cảm giác đau lan từ mông đến mặt sau ngoài đùi, mặt sau ngoài hay mặt ngoài cẳng chân, vòng ra phía trước mắt cá trong rồi ra phía mu chân và kết thúc ở ngón cái, đôi khi ở cả ngón hai. Trường hợp rễ S1 bị chèn ép, cảm giác đau lan dọc mặt sau đùi, mặt sau ngoài cẳng chân tới gót chân, bờ ngoài bàn chân tới ngón thứ năm. Đau kiểu rễ L4, cảm giác đau theo dải lan xuống mặt trước đùi và mặt trước trong cẳng chân. Đôi khi biểu hiện có thể đau không điển hình, tiến triển không đều thành đợt [8].
Về nguyên tắc, dựa vào vị trí của các rễ bị đau cũng như giới hạn của các khoanh da có rối loạn cảm giác, chúng ta xác định được khu vực tủy bị tổn thương.
1.2. Các phản xạ
Các phản xạ có giá trị định khu rất lớn nhờ ưu thế của chúng là không chịu ảnh hưởng của ý thức, cũng không bị sai lệch do các yếu tố chủ quan của người bệnh.
Các phản xạ được sử dụng phổ biến là phản xạ gối để thăm khám L3, phản xạ gót để thăm khám S1, phản xạ da đùi, bìu để thăm khám L1-L2, phản xạ hậu môn để thăm khám S4-S5 hay phản xạ bệnh lý tổn thương bó tháp như Babinski [10], [13].
1.3. Các khoanh cơ
Rễ trước thông qua trung gian là các đám rối và dây thần kinh để chỉ huy một nhóm cơ. Mỗi rễ trước chỉ huy một nhóm cơ ở một khu vực nhất định. Mỗi cơ cụ thể lại được chi phối bởi hai đến ba rễ, do đó tổn thương một rễ thường không gây liệt nặng do các rễ kế cận hỗ trợ.
Vì vậy, căn cứ vào cơ bị liệt, chúng ta có thể suy ra vị trí tương đối của các rễ thần kinh và đoạn tủy bị tổn thương [10], [13].
2. Triệu chứng lâm sàng
Hội chứng hẹp ống sống thắt lưng biểu hiện tổn thương có thể một hoặc nhiều rễ thần kinh thắt lưng, có thể bị một bên hoặc hai bên tuỳ vị trí tổn thương mà có các biểu hiện lâm sàng khác nhau với hai hội chứng chính là hội chứng cột sống và hội chứng rễ thần kinh [1].
2.1. Hội chứng cột sống
– Đau cột sống thắt lưng: có thể kèm đau thần kinh hông to trong nhiều năm và đã điều trị nhưng không khỏi.
– Biến dạng cột sống thắt lưng:
+ Mất ưỡn cột sống thắt lưng kèm co cứng phản xạ các cơ cạnh cột sống thắt lưng.
+ Gù, vẹo cột sống thắt lưng với cơ chế chống đau phản xạ của cột sống thắt lưng khi có đoạn vận động bị tổn thương.
– Có điểm đau cột sống và cạnh cột sống.
– Hạn chế tầm hoạt động của cột sống thắt lưng: hạn chế động tác gấp, duỗi, nghiêng, xoay cột sống thắt lưng [10].
2.2. Hội chứng rễ thần kinh
Hội chứng rễ: các triệu chứng tương ứng với vùng phân bố của rễ thần kinh bị tổn thương, có thể biểu hiện một bên hoặc hai bên:
– Đau các rễ thần kinh khi BN đi, nhất là đi xuống dốc, xuống cầu thang, hết đau khi cúi ra trước, khi dừng lại hoặc ngồi xuống.
– Khập khiễng cách hồi kiểu rễ: đau thắt lưng và đau rễ thần kinh xuất hiện khi BN đi được một đoạn hoặc đứng lâu, đặc biệt khi xuống dốc, xuống cầu thang buộc BN phải dừng lại. Tính chất đau bỏng rát, không có chuột rút, ngồi hoặc nằm đỡ đau hơn, đặc biệt khi ngồi hơi cúi đoạn thắt lưng đỡ đau nhanh hơn. Đau lại xuất hiện khi đi tiếp được một đoạn.
– Khập khiễng cách hồi kiểu đuôi ngựa: Cảm giác đau và chuột rút ở cả hai chân sau khi đi một đoạn hoặc đứng lâu. Đau tăng khi đi xuống dốc, cầu thang và hết đau khi cúi nhẹ ra trước.
– Rối loạn cảm giác lan dọc theo các phân đoạn cảm giác da.
– Teo cơ do rễ thần kinh chi phối bị tổn thương.
– Giảm hoặc mất phản xạ gân xương.
– Rối loạn thần kinh thực vật [1], [10], [13].
Dấu hiệu kích thích rễ: Các dấu hiệu kích thích rễ rất có giá trị chẩn đoán cao: dấu hiệu chuông bấm, dấu hiệu Lasègue, Bonnet, Nerri, điểm đau Valleix [4], [8].
Dấu hiệu tổn thương rễ:
– Giảm hoặc mất cảm giác da ở vị trí rễ bị đau.
– Yếu hoặc liệt cơ. Rối loạn dinh dưỡng (teo cơ).
– Giảm hoặc mất phản xạ gân xương, phản xạ da bụng, phản xạ bìu.
– Rối loạn thần kinh thực vật: giảm nhiệt độ da, giảm tiết mồ hôi, rối loạn dinh dưỡng da.
– Rối loạn cơ tròn: bí tiểu, tiểu tiện không tự chủ trong trường hợp tổn thương S3, S4, S5, hiếm gặp [9], [10].
3. Xét nghiệm dịch não tủy
Dịch não tủy là thành phần lưu thông trong khoang dưới nhện, nó được hình thành chủ yếu từ các đám rối mạch mạc. Bình thường dịch não tủy là một dịch trong suốt không màu, thể tích khoảng 100-150ml. Ở tư thế nằm, áp lực đo qua đường thắt lưng là 12-18cm nước. Dịch não tủy hầu như không chứa tế bào, chỉ vài tế bào lympho trong mỗi mm khối dịch não tủy. Trong hẹp ống sống, kết quả xét nghiệm dịch não tủy có thể cho thấy hàm lượng protein tăng nhẹ [1].
V. Thoát vị đĩa đệm
1. Phân loại các kiểu thoát vị đĩa đệm:
Đánh giá dựa trên hình ảnh CHT bằng cách quan sát các hình thái và mức độ tổn thương đĩa đệm và sự dịch chuyển khối thoát vị. Bao gồm sự thay đổi lan tỏa hoặc khu trú của đĩa đệm. Đĩa đệm còn nguyên vẹn hay biến đổi như rách vòng xơ, phình, lồi, thoát vị không có mảnh rời hoặc thoát vị có mảnh rời.
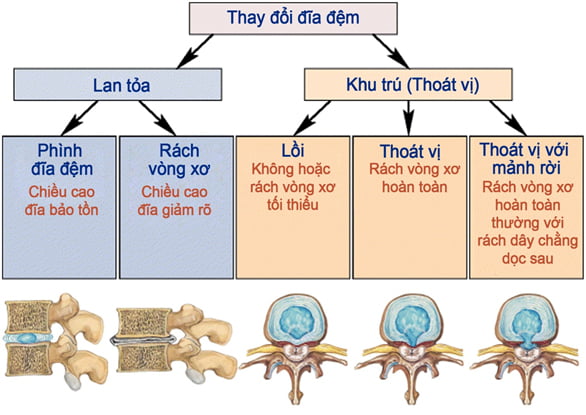
Hình 13. Minh họa sự biến đổi của đĩa đệm [48].
Dựa vào hình thái và tính chất, sự thoát vị của đĩa đệm theo khuyến cáo của khuyến cáo của Hiệp hội cột sống Bắc Mỹ (The North American Spine Society), Hiệp hội thần kinh Hoa Kỳ (The American Society of Neuroradiology) và Hội Điện quang cột sống Hoa Kỳ (The American Society of Spine Radiology), đánh giá trên các chuỗi xung T1W, T2W Axial và Sagittal, theo đó thoát vị đĩa đệm được chia làm 4 độ:
– Phình đĩa đệm: Đĩa đệm lớn lan tỏa (lớn hơn 50% chu vi, tức là hơn 180o), thường cân xứng hoặc lệch nhẹ về một phía do sự lỏng lẻo hay kéo giãn của vòng sợi.
– Lồi đĩa đệm: Phần nhân đĩa thoát vị khu trú ra khỏi phần đĩa còn lại nhưng vẫn còn chứa trong vòng sợi. Đường kính cổ túi thoát vị là lớn nhất. Có thể chia thành đáy rộng (25-50% chu vi) hoặc khu trú (thường nhỏ hơn 25% chu vi). Nhân tủy chứa trong vòng xơ nhưng bờ ngoài của vòng xơ không còn nguyên vẹn.
– Thoát vị đĩa đệm: Thoát vị khu trú, đường kính cổ túi nhỏ hơn phần túi và thường thoát vị qua vết nứt ở vòng xơ, có hướng lên trên hoặc xuống dưới theo chiều của trục cột sống (liên quan đến nhỏ hơn 25% chu vi, tức là nhỏ hơn 90o). Nhân nhầy thoát ra khỏi vòng xơ nhưng vẫn còn dính với phần nhân còn lại.
– Thoát vị mảnh rời: Là một mảnh đĩa đệm tự do thoát ra qua vòng sợi, tách rời khỏi phần đĩa còn lại và nằm trong khoang ngoài màng cứng.
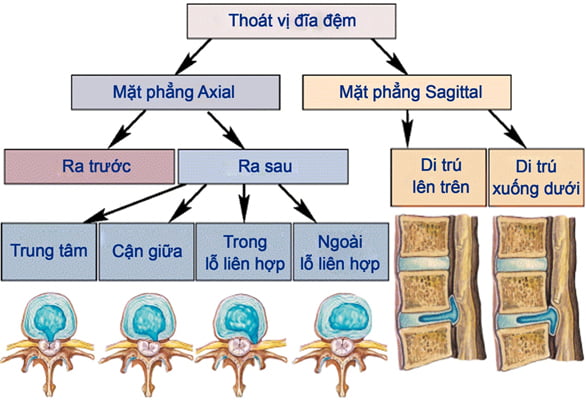
Hình 14. Minh họa thoát vị đĩa đệm [48]
Ngoài ra còn phân lại thoát vị đĩa đệm trên mặt phẳng ngang (tương ứng với lồi đĩa đệm, thoát vị đĩa đệm và thoát vị mảnh rời) gồm các kiểu: ra trước, sau, bên (gồm có trong và ngoài lỗ liên hợp) [37]. Trong đó kiểu ra sau được phân thành các thể: trung tâm – cận giữa phải – cận giữa trái [9], [30], [48].
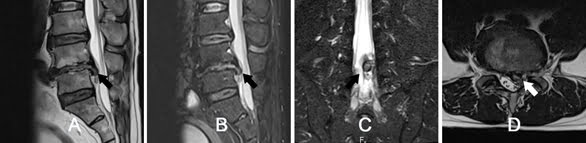
Hình 15. Thoát vị đĩa đệm trên cộng hưởng từ. Bệnh nhân Lê Văn H, 52 tuổi. A và B: Chuỗi xung T2W và STIR Sagittal, thoát vị đĩa đệm ra sau di trú xuống dưới. C và D: Chuỗi xung STIR Coronal và T2W Axial, thoát vị trong ống sống trung tâm, cận giữa và trong lỗ liên hợp.
2. Phân độ chèn rễ thần kinh, ghi nhận theo phân độ của Pfirrmann:
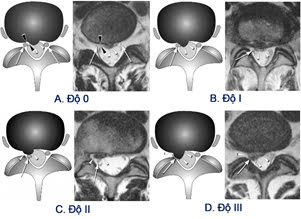
Hình 16. Phân độ chèn ép rễ [61]
Độ 0: Không chèn (normal).
Độ I: Tiếp xúc (contact). Chất thoát vị tiếp xúc với rễ. Mất lớp mỡ ngoài màng cứng, rễ không bị đẩy lệch.
Độ II: Đẩy lệch (deviation). Phần lưng rễ thần kinh bị đẩy lệch.
Độ III: Chèn ép (compression). Rễ dẹt và không phân biệt được rễ thần kinh với chất thoát vị [61].
VI. Chẩn đoán hình ảnh hội chứng hẹp ống sống thắt lưng
1. Chụp Xquang quy ước
Khái quát:
Là một cận lâm sàng thường quy với ba tư thế: thẳng, nghiêng và chếch 3/4. Ngoài ra còn chụp thêm tư thế gập ưỡn tối đa để đánh giá đầy đủ [22]. Dựa vào phim XQ, người ta có thể đánh giá đường cong sinh lý của cột sống, khớp đốt sống, khoang gian đốt, kích thước lỗ liên hợp, mật độ xương và cấu trúc xương, các dị tật bẩm sinh. Qua đây, có thể có các dấu hiệu gợi ý nguyên nhân như loãng hay đặc một thân đốt sống hay cuống sống, lún xẹp đốt sống hay viêm đốt sống, sụn đĩa đệm [9]. Ngoài ra cũng có thể chẩn đoán hẹp ống sống thắt lưng dựa vào các chỉ số trên XQ được chứng minh có tương quan với lâm sàng và CHT [27].
Kỹ thuật chụp:
Chụp XQ CSTL các tư thế thẳng, nghiêng, tư thế bổ sung [9]. Thông số chụp trong khoảng: thẳng 75-80Kv, 40mAs; nghiêng 75-80Kv, 50mAs. Khoảng cách bóng 1m, có lưới chống mờ. Tùy độ dày của bộ phận chụp mà điều chỉnh các yếu tố chụp phù hợp để có chất lượng hình ảnh tốt nhất. Tùy theo công suất của máy XQ để ta có thể điều chỉnh các thông số kỹ thuật để kéo dài độ bền hoạt động của máy đồng thời đảm bảo cường độ các thông số kỹ thuật phải vừa đủ để tạo nên một hình ảnh đẹp.
– Chụp thẳng: BN nằm ngửa, đầu gối cao và chân gấp để lưng hết cong. Tia trung tâm vuông góc với bàn, chiếu vào đốt sống L3-L4 (điểm trên đường giữa cách 2cm so với đường nối 2 mào chậu), đi vào giữa cassette.
– Chụp nghiêng: BN nằm nghiêng về phía nào thuận tiện nhất, chân và đầu gối co lên bụng, lưng vuông góc mặt bàn. Tia trung tâm khu trú trên mào chậu 3 khoát ngón tay.
– Chụp tư thế bổ sung: Ngoài ra có thể chụp thêm tư thế chếch 3/4 để thấy rõ tổn thương ở cung sau và mấu khớp, chụp ở tư thế đứng hoặc nằm trong một số trường hợp, chụp các tư thế ưỡn tối đa và gập tối đa để đánh giá gù và trượt đốt sống. Các tư thế thẳng, bệnh nhân nghiêng sang hai bên giúp đánh giá vẹo cột sống [16], [43], [64].
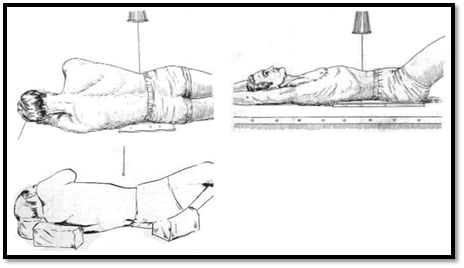
Hình 17. Minh họa một vài tư thế chụp Xquang cột sống thắt lưng [5].
Các dấu hiệu bệnh lý trên XQ:
Gai xương, đặc xương dưới sụn, hẹp khe khớp, vôi hóa đĩa đệm, khí đĩa đệm, giảm mất đường cong sinh lý, gù vẹo cột sống, tiêu eo, trượt đốt sống, gai đôi, cùng hóa đốt sống, xẹp vỡ đốt sống, và các đặc điểm khác.
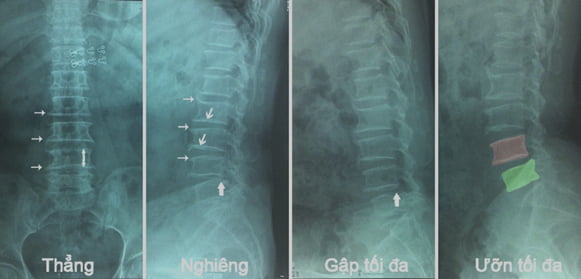
Hình 18. Hình ảnh Xquang minh họa của bệnh nhân 54 tuổi. Chụp XQ thường quy 2 tư thế thẳng nghiêng và tư thế bổ sung gập ưỡn tối đa. Các dấu hiệu như gai xương (mũi tên nhỏ), đặc xương dưới sụn (mũi tên vừa), dấu hiệu trượt L4-L5 chỉ phát hiện trên tư thế gập ưỡn tối đa, trên phim nghiêng thường quy khó phát hiện (mũi tên lớn).
2. Chụp tủy bơm cản quang
Là phương pháp bơm chất cản quang tan trong nước (ví dụ Iopamiron) vào dịch não tủy trong ống sống để chụp. Đây là một phương pháp giúp thăm khám các khoang dưới nhện thắt lưng cùng và nón tủy. Kỹ thuật này trước đây là một phương pháp hết sức quan trọng để xác định chèn ép trong ống sống. Tuy nhiên ngày nay nhờ có các phương pháp thăm dò hiện đại khác nên phương pháp này ít được áp dụng hơn và phương pháp này có thể được chỉ định khi có chống chỉ định với chụp CLVT và CHT.
Kỹ thuật này giúp xác định vị trí hẹp và vị trí bị chèn ép, chèn ép một phần hay toàn bộ, trong màng cứng hay ngoài màng cứng. Theo Hồ Hữu Lương (1986) với kỹ thuật chụp nhuộm bao rễ, thoát vị đĩa đệm chia làm 4 độ:
Độ 1: Hẹp ≤ 1/4 đường kính bao rễ thần kinh.
Độ 2: Hẹp trên 1/4 đến 2/4 bao rễ thần kinh.
Độ 3: Hẹp trên 2/4 đến 3/4 bao rễ thần kinh.
Độ 4: Hẹp > 3/4 bao rễ thần kinh [4], [10].
3. Chụp cắt lớp vi tính
Trước đây với các thiết bị thế hệ cũ thì giá trị của CLVT trong chẩn đoán bệnh lý tủy sống có nhiều hạn chế do khó tạo ảnh rõ ràng theo chiều dọc, khó đánh giá khi ống sống bị xâm lấn hoàn toàn, các hình ảnh giả do xương tạo ra, cần phải xác định chính xác đoạn ống sống cần chụp vì không thể thăm khám toàn bộ chiều dài ống sống.
Với sự ra đời của CLVT đa lát cắt, chất lượng hình ảnh tốt hơn và có thể tái tạo lại theo nhiều mặt phẳng, thời gian rút ngắn, giúp đánh giá bệnh lý cột sống tốt hơn. Có thể khảo sát được toàn bộ cột sống, nhưng CLVT có nhược điểm là nhiễm xạ [9], khảo sát tốt xương và vôi hóa nhưng khảo sát mô mềm và các thành phần liên quan, đặc biệt là đánh giá tủy sống thì không tốt bằng CHT.
Trong một số trường hợp không thể chụp CHT, có thể chụp CLVT kèm tiêm thuốc cản quang hoặc chụp CLVT nhuộm tủy cản quang.
Trên phim chụp CLVT, có thể đo được đường kính ống sống và phát hiện hẹp ống sống bẩm sinh hay mắc phải, các dị dạng đốt sống, các tổn thương thân đốt, cung sau, đĩa đệm. Các tổn thương trong màng cứng, quanh màng cứng thường chỉ quan sát được sau khi tiêm thuốc cản quang hoặc chụp ngay sau khi chụp tủy cản quang như trong các trường hợp viêm dính màng nhện hay khối u trong ống sống.
Đã có nghiên cứu chứng minh CLVT cột sống thắt lưng liều thấp (khoảng 1 -1.1mSv) có chất lượng hình ảnh vượt trội hơn chụp XQ cột sống thắt lưng (khoảng 0.7mSv), cung cấp nhiều thông tin về giải phẫu và hỗ trợ chẩn đoán tốt hơn, có thể thay thế trong thực hành lâm sàng [21].
4. Chụp cộng hưởng từ cột sống
Khái quát:
Kỹ thuật chụp CHT là một kỹ thuật hình ảnh được ứng dụng trong lâm sàng từ đầu thập kỷ 80 với tên gọi ban đầu là CHT hạt nhân với các tín hiệu hình ảnh bắt nguồn từ các hạt nhân nguyên tử Hydro trong các mô cơ thể. Do lợi ích của CHT đối với chẩn đoán bệnh và tính không độc hại, công nghệ CHT phát triển rất nhanh chóng [11].
Hình 19. Hình ảnh minh họa máy CHT.
Kỹ thuật chụp CHT:
Bệnh nhân nằm ngửa, dùng coil CSTL [17]. Sử dụng các chuỗi xung cơ bản sau:
– Sagittal T1W, ma trận 320×320, trường chụp 260*260, bề dày lát cắt 4mm, bước nhảy 0.8mm, với các thông số chụp tối ưu.
– Sagittal T2W, ma trận 384×384, trường chụp 260*260, bề dày lát cắt 4mm, bước nhảy 0.8mm, với các thông số chụp tối ưu.
– Sagittal STIR, ma trận 256×256, trường chụp 260*260, bề dày lát cắt 4mm, bước nhảy 0.8mm, với các thông số chụp tối ưu.
– Axial T2W theo các tầng đĩa đệm nghi ngờ, ma trận 384×384, trường chụp 220*220, bề dày lát cắt 4mm, bước nhảy 0.4mm, với các thông số chụp tối ưu.
– Ngoài ra tùy tổn thương đi kèm có thể chụp thêm chuỗi xung Axial T1W, Axial T2*, Coronal STIR, Sagittal T2-Space xóa mỡ, chuỗi xung khuếch tán và CISS 3D (Constructive Interference in Steady-State 3 chiều), WARP (High Bandwidth), hoặc T1W sau tiêm thuốc tương phản tạo ảnh các mặt phẳng [15].
Ưu điểm của kỹ thuật CHT:
CHT là kỹ thuật cho các thông tin đầy đủ nhất và trung thực nhất về mặt giải phẫu trong đa số các trường hợp. Nó có thể thăm khám các cấu trúc với các lớp cắt mỏng và tạo ảnh theo nhiều hướng trong không gian.
Trên phim CHT, người ta có thể quan sát cùng một bệnh lý với nhiều hình ảnh tương phản khác nhau qua các chuỗi xung khác nhau. Nhờ các kỹ thuật và các chuỗi xung của CHT mà chúng ta có thể quan sát cơ thể sống bằng cách tạo ra những hình ảnh giống như thể chúng ta đang cắt cơ thể sống ra thành từng lớp để biết các cấu trúc đang sống như thế nào. Nhờ đó sẽ giúp thấy rõ khu vực tổn thương và ảnh hưởng đối với mô kế cận. Khi cần thiết có thể bơm thuốc tương phản từ, sẽ cho thêm các thông tin hết sức quan trọng. Ngoài ra, hệ thống đo đạc và chuỗi xung tạo ảnh phong phú của kỹ thuật CHT giúp thầy thuốc có nhiều thông tin đầy đủ về tổn thương [11].
Sự vô hại của phương pháp chụp CHT cũng là một ưu thế rất lớn. Trong chụp CHT, người chụp sẽ không bị nhiễm xạ và có thể chụp được trong thai kỳ.
CHT đánh giá tốt mô mềm, tủy sống và các thành phần liên quan. Với sự phát triển của kỹ thuật, các máy chụp CHT càng ngày càng hiện đại, từ lực trong máy càng tăng lên, chất lượng hình ảnh tốt hơn, thời gian chụp càng rút ngắn. CHT là hiện tại là phương pháp tốt nhất đánh giá hệ thần kinh cột sống.
Nhược điểm của kỹ thuật CHT:
Bên cạnh những điểm tốt, CHT cũng có vài bất lợi như: Các vấn đề về an toàn CHT (tác dụng sinh học, không tương thích giữa các thiết bị y tế, từ trường biến thiên, tiếng ồn và chất làm lạnh). Các nhiễu ảnh (do hiện tượng aliasing, do sự dịch chuyển hóa học, nhiễu ảnh điểm trung tâm, nhiễu ảnh bóng ma, nhiễu ảnh xương cá, nhiễu ảnh khóa kéo, nhiễu ảnh cảm nhiễm từ). Vì vậy cần đòi hỏi kỹ thuật vận hành phải được đào tạo bài bản [14].
Vai trò của chụp CHT trong chẩn đoán các bệnh lý ở tủy sống:
CHT là phương pháp có thể tạo hình ảnh theo bất kỳ hướng nào trong không gian. Vì vậy, chúng ta có thể xác định cụ thể và chính xác vị trí tổn thương, kích thước các chiều trong không gian của nó, cũng như tương quan của tổn thương với các thành phần khác của tủy, rễ thần kinh và cột sống. Ngoài ra, trên phim CHT cũng giúp đánh giá những tổn thương của các phần xung quanh cột sống như các cơ và các tạng lân cận. Nhờ vào độ tương phản và sự tạo ảnh đa dạng dựa trên nhiều chuỗi xung kèm theo sự thay đổi sau bơm thuốc tương phản từ sẽ rất hữu ích để đánh giá được bản chất của tổn thương.
Hình ảnh cột sống thắt lưng trên phim chụp CHT:
– Đốt sống:
+ Bình thường: Gồm hai phần, phần vỏ xương có viền ngoài giảm tín hiệu trên ảnh T1W, phần tủy tín hiệu cao và đồng nhất hơn do có nhiều phân tử mỡ. Các đốt sống sắp xếp đều đặn tạo nên đường cong sinh lý.
+ Bệnh lý: Có thể thấy tổn thương ở thân đốt sống như xẹp, tiêu xương, thâm nhiễm, gãy nứt… Cũng như tổn thương các mỏm sống, các cuống, cung sau và các phần mềm kế cận.
– Đĩa đệm và dây chằng:
+ Bình thường: Là tổ chức đồng nhất tín hiệu giữa các đốt sống. Các đĩa đệm và nhân đĩa đệm tăng tín hiệu trên ảnh T2W do cấu trúc giàu phân tử nước, biểu hiện trên ảnh T1W thường giảm tín hiệu. Các đĩa đệm có ranh giới rõ, giới hạn trước và sau bằng dây chằng dọc trước và dây chằng dọc sau, phía trên và phía dưới là các đốt sống liền kề.
+ Bệnh lý: Thoái hóa, thoát vị đĩa đệm và các ảnh hưởng của nó đến tủy và các rễ thần kinh. Dày, vôi hóa các dây chằng gây chèn ép tủy và các rễ thần kinh.
– Ống sống: Là khoang chứa dịch não tủy, trung tâm là tủy sống và chùm đuôi ngựa.
+ Dịch não tủy là tổ chức đồng nhất, giảm tín hiệu trên T1W (màu đen), rất tăng tín hiệu trên T2W (màu trắng), bao quanh cột tủy và rễ chùm đuôi ngựa.
+ Trên hình ảnh CHT, ta có thể phát hiện mức độ hẹp ống sống, các hình thái của hẹp ống sống, các bất thường trong và ngoài màng cứng như: Áp xe, khối u, dị dạng mạch máu, khối máu tụ.
– Các cấu trúc khác: Mỡ, xương, cơ, da, tổ chức dưới da cũng rất rõ ràng [9], [36].
Chống chỉ định chụp CHT:
– Chống chỉ định tuyệt đối: BN có van tim nhân tạo, máy tạo nhịp, máy khử rung. Người có Stent mạch máu, có dị vật kim loại trong cơ thể. Sau phẫu thuật dưới 6 tuần. BN có mang các thiết bị y tế hỗ trợ không thể tháo rời.
– Thận trọng: BN sau phẫu thuật có sử dụng vật liệu từ tính. Phụ nữ mang thai hoặc cho con bú. BN suy thận, rối loạn điều nhiệt. Trẻ em, hội chứng sợ nhốt kín [15].
Tóm lại, CHT có nhiều tính ưu việt trong chẩn đoán bệnh lý cột sống. Tuy nhiên cũng không nên lạm dụng để sử dụng thường xuyên cho mục đích kiểm tra đau lưng và đánh giá sức khỏe [79].
Các bệnh lý thường gặp trên CTH:
Thoái hóa cột sống, thoái hóa đĩa đệm, thoái hóa mấu khớp, thoái hóa Modic, thoát vị đĩa đệm, phì đại dây chằng vàng, phì đại dây chằng dọc sau, gù vẹo cột sống, trượt đốt sống, viêm, lao, u, dị dạng mạch máu, các bệnh lý loạn sản cột sống, và các bệnh lý khác.
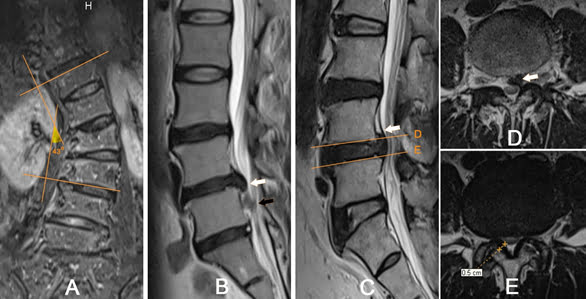
Hình 20. Một vài hình ảnh cộng hưởng từ minh họa. Hình A – Bệnh nhân 63 tuổi: Vẹo cột sống đo theo phương pháp Cobb trên mặt phẳng Coronal [29], Cobb=43o. Hình B – Bệnh nhân Lương Thị Tường V, 34 tuổi: Thoát vị ra sau trên chuỗi xung T2W mặt phẳng Sagittal (mũi tên trắng), có mảnh rời tín hiệu cao hơn gây hẹp ống sống (mũi tên đen). Hình C, D và E – Bệnh nhân 64 tuổi: Chuỗi xung T2W mặt phẳng Sagittal và mặt phẳng Axial tương ứng, thoát vị đĩa đệm L4-L5 di trú lên trên (mũi tên ở hình C và D), kèm phì đại dây chằng vàng gây hẹp ống sống mức độ nặng (hình E).
5. Chẩn đoán hẹp ống sống
5.1. Khái quát
Hẹp ống sống thắt lưng là sự thu hẹp kích thước của ống sống thắt lưng bởi các thành phần xương hoặc mô mềm, bao gồm hẹp ống trung tâm, hẹp ngách bên (vị trí dưới mặt khớp), hẹp lỗ liên hợp, hoặc phối hợp các vị trí [52], [57].
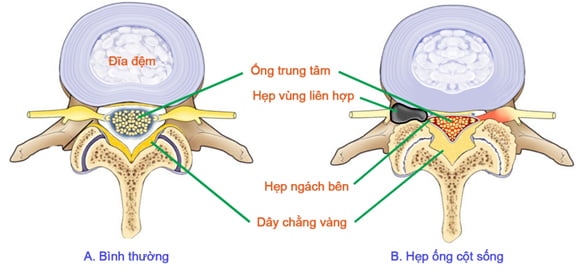 Hình 21. Hình ảnh minh họa hẹp ống sống thắt lưng.
Hình 21. Hình ảnh minh họa hẹp ống sống thắt lưng.
(https://www.mayfieldclinic.com/pe-sten.htm)
Ống sống trung tâm: nằm ở trung tâm, chứa màng cứng, trong có tủy cùng, chóp cùng và đuôi ngựa. Đường kính trước sau đo ở giữa của ống sống giảm dần từ L1 đến L4, tăng lên ở L5 rồi giảm ở S1 [8]. Chiều trước sau ống sống trên hướng đứng dọc trung bình 15-18mm [1]. Chiều ngang ống sống đo ngang mức cuống sống ở đoạn L1-L4 là trên 20-21mm, ở đoạn L5 là trên 24mm [10].
Ngách bên: là nơi đi ra của rễ thần kinh xuất phát từ tủy sống đến khi đi vào giữa dưới cuống cung của đốt sống tương xứng [8]. Hẹp ngách bên còn gọi là hẹp vùng đi vào của rễ, bắt đầu từ bờ ngoài của túi màng cứng tới bờ trong của cuống sống.
Lỗ liên hợp: được giới hạn ở phía trước là thân đốt sống và đĩa đệm, phía sau là diện khớp, phía trên và dưới là cuống sống của hai đốt sống liền kề. Chiều rộng của lỗ liên hợp tương đương với chiều dài của cuống sống, khoảng từ 8 đến 15mm [8].
5.2. Tiêu chuẩn trên Xquang
– Chỉ số Jones–Thomson
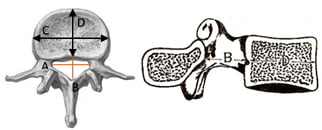
Hình 22. Các số đo trong chỉ số Jones–Thomson [40]. Chỉ số Jones–Thomson = (A x B) / (C x D). Trong đó: A và B là chiều ngang và chiều trước sau của ống sống. C và D là chiều ngang và chiều trước sau của thân đốt sống cùng mức.
Bình thường chỉ số Jones–Thomson vào khoảng 0.22 đến 0.5, được xác định là hẹp khi giảm dưới 0.22, rộng khi tăng trên 0.5 [40].
– Tỷ số SBW:PW
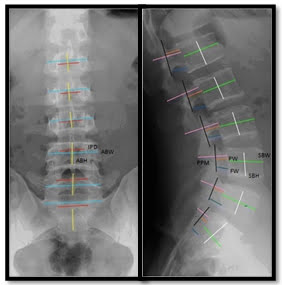
Hình 23. Chỉ số hẹp ống sống. Hẹp ống sống khi tỷ số SBW:PW>2.8 (SBW – Sagittal Vertebral Body Width: là kích thước trước sau của thân đốt sống đo trên hình ảnh XQ nghiêng; PW – Pedicle Width: là độ dài cuống sống) [27].
Jason Pui Yin Cheung và cộng sự đã đưa ra nhiều chỉ số XQ, như đường kính ngang và trước sau của thân đốt sống, độ dài cuống sống và độ rộng ống sống ngang, độ rộng lỗ liên hợp. Nhưng cho rằng tỷ số SBW:PW >2.8 xác định có hẹp ống sống thắt lưng – cùng tiến triển, có diện tích dưới đường cong, độ nhạy và độ đặc hiệu cao nhất [27].
5.3. Tiêu chuẩn trên cộng hưởng từ
Phân độ hẹp theo một số tác giả:
– Theo Verbiest (1976): Đường kính trước sau ống sống vùng thắt lưng nhỏ hơn 10mm thì được coi như hẹp tuyệt đối và nếu 10-12mm là hẹp tương đối [68], [76].
– Theo Modic M.T (1999) chia làm bốn mức độ hẹp ống sống dựa trên CHT:
Độ 1: Hẹp nhẹ, đường kính trước sau ống sống còn từ 10-12mm.
Độ 2: Hẹp vừa, đường kính trước sau ống sống còn từ 7-9mm.
Độ 3: Hẹp nặng, đường kính trước sau ống sống còn từ 4-6mm.
Độ 4: Hẹp rất nặng, đường kính trước sau ống sống còn từ 0-3mm [4].
– Theo Schizas C và cộng sự (2010) phân loại 7 cấp độ (A1, A2, A3, A4, B, C, D) dựa trên hình thái của túi màng cứng và tỷ lệ chùm đuôi ngựa và dịch não tủy [66].
– Theo Lee GY và cộng sự (2011) đã đưa ra một hệ thống phân loại hẹp ống sống trung tâm trên CHT, một phương pháp tin cậy và dễ áp dụng. Hệ thống phân loại này dựa vào hình thái ống sống, chùm đuôi ngựa và khoang dịch não tủy [49].
– Theo Mamisch N và cộng sự (2012) đã đưa ra các giá trị ngưỡng trên hình ảnh học để chẩn đoán hẹp ống sống, ví dụ như đường kính trước sau túi cùng màng cứng <12mm, đường kính lỗ liên hợp <3mm và chiều cao ngách bên <3mm [56].
– Theo Yuan S và cộng sự (2016) đã phân độ hẹp ống sống thành 4 độ theo hình thái của ống sống trung tâm, túi màng cứng, và mức độ chèn ép chùm đuôi ngựa [80].
Sau đây sẽ trình bày một số loại hẹp cơ bản, phân loại hẹp ba vị trí đó là, hẹp ống sống trung tâm, hẹp ngách bên, hẹp lỗ liên hợp:
– Phân độ hẹp ống sống trung tâm:
Theo Lee GY và cộng sự (2011), hẹp ống sống trung tâm khi khoang trước dịch não tủy bị xóa, chia làm 4 độ (Hình 24): độ 0 không hẹp; độ 1 hẹp nhẹ, nhưng vẫn quan sát được sự tách biệt rõ ràng của mỗi rễ thần kinh trong chùm đuôi ngựa; độ 2 hẹp vừa, vài rễ của chùm đuôi ngựa nằm sát lại với nhau; độ 3 hẹp nặng, chùm đuôi ngựa bó lại [49].
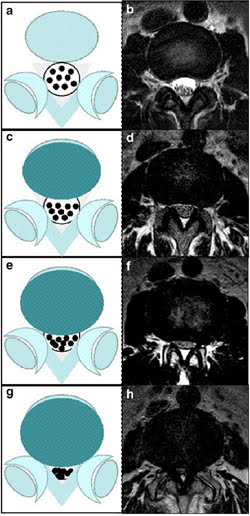 Hình 24. Hẹp ống sống trung tâm theo Lee GY và cộng sự chia làm 4 độ. a-b: bình thường; c-d: hẹp nhẹ; e-f: hẹp vừa; g-h: hẹp nặng [49].
Hình 24. Hẹp ống sống trung tâm theo Lee GY và cộng sự chia làm 4 độ. a-b: bình thường; c-d: hẹp nhẹ; e-f: hẹp vừa; g-h: hẹp nặng [49].
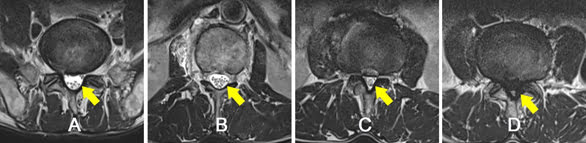
Hình 25. Mức độ hẹp ống sống trung tâm. Bệnh nhân 75 tuổi: hình A – không hẹp, hình B – hẹp nhẹ, hình C – hẹp vừa, hình D – hẹp nặng (các mũi tên).
– Phân độ hẹp ngách bên:
Dựa vào tiêu chuẩn của Bartynski W. S. và cộng sự (2003) dựa vào hình thái của ngách bên. Đè nén rễ thần kinh ở ngách bên thường xuất hiện hai dạng hình thái (Hình 2.4): Hẹp dạng ba lá (bẩm sinh hoặc mắc phải) do sự giảm kích thước trước sau của kênh bên (Hình 26, cột A và B) hoặc hẹp dạng góc cạnh do sự lõm góc mép bên của kênh bên gây ra sự nhô ra thứ phát của rễ thần kinh (Hình 26, cột C và D). Hệ thống phân loại nhận ra sự nén ép rễ thần kinh và túi màng cứng, với việc xác định một phần hoặc toàn bộ dịch não tủy ở kênh bên ống sống và ngách bên bị biến mất [25]. Phân độ dựa vào hình thái của chúng tôi chỉ lựa chọn những trường hợp hẹp ngách bên mắc phải (Hình 26 – B, C và D). Chúng tôi loại trừ là các trường hợp hẹp ngách bên bẩm sinh đơn thuần trong nghiên cứu (Hình 26 – A).
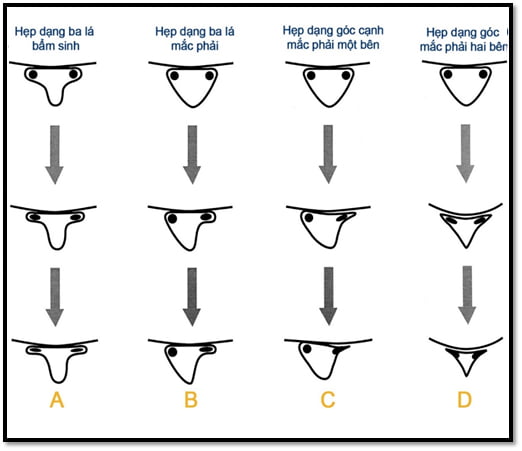
Hình 26. Các hình thái hẹp ngách bên, theo các mức độ tăng dần [25].
Các hình thái hẹp của ngách bên được mô tả ở hình 26: Cột A, kênh hẹp dạng ba lá bẩm sinh. Vùng ngách bên trở nên thu hẹp dần do các sự thoái hóa của mặt khớp hoặc thay đổi đĩa sụn tận cùng của đốt sống. Cột B, kênh hẹp dạng ba lá mắc phải. Những thay đổi do thoái hóa sớm và phì đại của mặt khớp làm hẹp ngách bên trong một kênh hình tam giác thu hẹp, biến đổi thành hẹp dạng ba lá với rễ thần kinh vẫn nằm trong ngách bên. Sự thoái triển của bề mặt đĩa, đĩa sụn tận cùng, hoặc thêm vào sự thoái hóa của mặt khớp dẫn đến rễ thần kinh bị đè ép và mắc kẹt. Cột C, hẹp kênh bên mắc phải dạng góc cạnh. Đồng thời với sự thu hẹp đồng đều gây ra bởi sự thoái hóa của mặt khớp, đĩa sụn tận cùng và bề mặt đĩa đệm, dẫn đến sự hẹp cấp tính dạng góc của kênh bên ống sống và ngách bên. Rễ thần kinh sẽ bị nén dần dần ở vùng ngách bên và có thể bị đè đẩy vào phía trong. Cột D, hẹp kênh bên mắc phải dạng góc cạnh hai bên. Cả hai bên mặt khớp, bờ đĩa đệm và đĩa sụn tận cùng thoái hóa có thể làm hẹp ống sống trung tâm và kênh bên. Điều này có thể làm hẹp ống sống trung tâm với đè ép chùm đuôi ngựa và đè ép các rễ thần kinh riêng rẽ trong ngách bên [25].
– Phân độ hẹp lỗ liên hợp:
Theo Lee Seunghun (2010) chia làm 4 độ cải tiến bằng cách sửa đổi phân loại của Kunogi và Hasue, như minh họa trong hình 27 A-E.
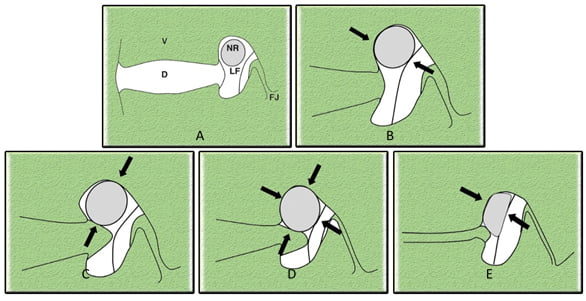
Hình 27. Phân độ hẹp lỗ liên hợp theo mô hình 4 độ. A – Độ 0 (bình thường) Sơ đồ của mặt cắt qua mặt phẳng đứng dọc, cho thấy các mối quan hệ giữa các cấu trúc con và các cấu trúc xung quanh. NR = Rễ thần kinh, V = Thân đốt sống, D = Đĩa đệm, LF = Dây chằng vòng, FJ = Mặt khớp. B và C – Độ 1 (hẹp nhẹ) Xóa nhẹ lớp mỡ quanh rễ chỉ theo một hướng. D – Độ 2 (hẹp vừa) Xóa lớp mỡ quanh rễ theo 2 hướng đối diện, chưa thay đổi hình thái rễ. E – Độ 3 (hẹp nặng) Xóa lớp mỡ quanh rễ, chèn ép và làm thay đổi hình thái rễ [51].
Độ 0: Lỗ liên hợp bình thường, bao quanh bởi lớp mỡ, dây chằng vòng, đốt sống đĩa đệm và mặt khớp. Độ 1: Hẹp nhẹ, biểu hiện xóa nhẹ bao quanh rễ thần kinh một trong hai hướng đối diện (theo chiều dọc hoặc ngang). Nó liên quan đến sự tiếp xúc của phần trên và dưới của rễ thần kinh hoặc phần trước và sau của rễ thần kinh. Không có bằng chứng về sự thay đổi hình thái của rễ thần kinh. Ở loại hẹp này lỗ liên hợp bị ép, thường là do hẹp khe gian đĩa và phì đại dây chằng vòng và mỏm khớp. Độ 2: Hẹp trung bình, cho thấy sự xóa lớp mỡ bao quanh rễ thần kinh trong bốn hướng mà không thay đổi hình thái, ở cả hai hướng dọc và ngang. Độ 3: Hẹp nặng, cho thấy sự xẹp, méo mó của rễ thần kinh hoặc thay đổi hình thái [51].
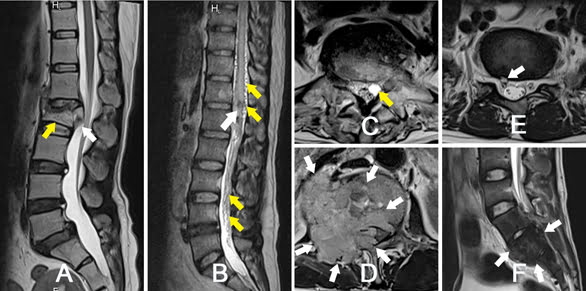
Hình 28. Hình minh họa một vài nguyên nhân gây hẹp ống sống ít gặp. Hình A – Bệnh nhân 43 tuổi: Hình ảnh T2W Sagittal, vỡ xẹp L2 (mũi tên vàng) có mảnh rời gây hẹp ống sống (mũi tên trắng). Hình B – Bệnh nhân 40 tuổi: Hình ảnh T2W Sagittal, dị dạng mạch máu vùng nón tủy (mũi tên trắng), các mạch máu dị dạng trên bề mặt (mũi tên vàng). Hình C – Bệnh nhân 74 tuổi: Nang màng nhện vị trí ngách bên ngang mức L5. Hình D – Bệnh nhân 54 tuổi: Chuỗi xung T2W Axial, khối u cột sống đoạn L1-L2 gây hẹp ống sống (mũi tên). Hình E – Bệnh nhân 52 tuổi, nang Tarlov rễ S1 (mũi tên). Hình F – Bệnh nhân 24 tuổi, khối u vùng thắt lưng cùng (giải phẫu bệnh là sarcoma xương).
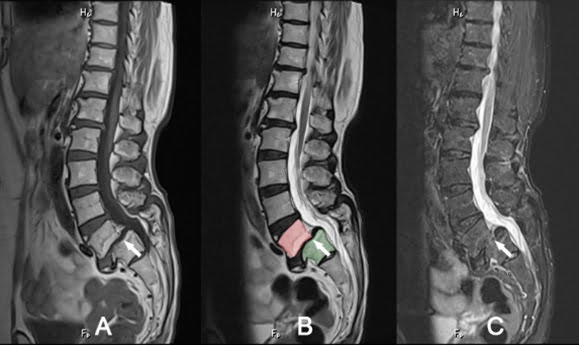
Hình 29. Hình ảnh cộng hưởng từ trượt đốt sống. Bệnh nhân 65 tuổi. Mặt phẳng Sagittal chuỗi xung T1W (hình A), T2W (hình B) và STIR (hình C). Trượt L4-L5 độ I (mũi tên) gây thoát vị đĩa đệm ra trước, kèm theo thoái hóa Modic II các thân đốt sống.
VII. Điều trị
1. Điều trị bảo tồn
Nằm bất động khi đau nhiều, chỉ định vitamin nhóm B liều cao, giảm đau và chống viêm không steroid, thuốc giãn cơ kết hợp với vật lý trị liệu, châm cứu, bấm huyệt. Trong một số trường hợp đặc biệt có thể cần phong bế ngoài màng cứng, phong bế cạnh cột sống thắt lưng, phong bế rễ thần kinh ở lỗ gian đốt và điều trị nguyên nhân.
2. Điều trị phẫu thuật
Điều trị phẫu thuật được chỉ định khi điều trị bảo tồn không có kết quả, liệt hai chi dưới và có rối loạn cơ tròn. Phẫu thuật giải ép cho bệnh nhân có biểu hiện đau nổi trội do chèn ép thần kinh đã được chứng minh là mang lại kết quả lâu dài có lợi nhất [31].
3. Điều trị phục hồi chức năng
Như vận động trị liệu, kéo giãn cột sống, châm cứu, xoa bóp [1].
VIII. Tài liệu tham khảo
[1] Lê HA (2015), Nghiên cứu đặc điểm hình ảnh và giá trị của cộng hưởng từ trong hội chứng hẹp ống sống thắt lưng cùng, Luận văn Thạc sĩ Y học, Đại học Y Hà Nội.
[2] Lê TB (2010), Nghiên cứu đặc điểm hình ảnh Xquang và cộng hưởng từ trong thoái hóa đĩa đệm cột sống thắt lưng, Luận văn Thạc sĩ Y học, Đại học Y Dược Huế.
[3] Nguyễn VC et al. (2015), “Nghiên cứu thoát vị đĩa đệm cột sống thắt lưng tại Bộ môn – Khoa Nội thần kinh, bệnh viện 103 – Học viện Quân Y: Số liệu thu thập trong 10 năm gần đây (2004-2013) với 4718 bệnh nhân”, Tạp chí Y – Dược Học Quân Sự(Số 3), pp.5-16.
[4] Lê NC (2008), Nghiên cứu đặc điểm lâm sàng, hình ảnh Xquang thường quy và cộng hưởng từ ở bệnh nhân trượt đốt sống thắt lưng, Luận văn Cao học, Đại học Y Dược Huế.
[5] Nguyễn DC et al (2008), “Kỹ thuật chụp cột sống”, Kỹ thuật chụp Xquang thông thường, Tập 1, Nhà xuất bản Y học, pp.134-140.
[6] Phạm TNH (2014), Nghiên cứu ứng dụng trong lâm sàng phân loại thoát vị đĩa đệm cột sống thắt lưng trên cộng hưởng từ theo đại học Michigan, Luận văn Thạc sĩ của Bác sĩ nội trú, Đại học Y Dược Huế.
[7] Phạm BH (2013), Nghiên cứu đặc điểm hình ảnh Xquang và cộng hưởng từ cột sống thắt lưng ở bệnh nhân đau thần kinh tọa, Luận văn Thạc sĩ của Bác sĩ nội trú, Đại học Y Dược Huế.
[8] Nguyễn ĐL (2011), Nghiên cứu chẩn đoán lâm sàng, hình ảnh học và đánh giá kết quả phẫu thuật hẹp ống sống thắt lưng – cùng tại bệnh viện Việt Đức, Luận văn Bác sĩ nội trú, Đại học Y Hà Nội.
[9] Hoàng ML et al. (2016), Hình ảnh học cột sống và ống sống: Kỹ thuật và diễn giải kết quả, Nhà xuất bản Đại học Huế, pp.1-63.
[10] Hồ HL (2012), Đau thắt lưng và thoát vị đĩa đệm, Nhà xuất bản Y học, pp.1-250.
[11] Trần ĐQ (2014), Nguyên lý và Kỹ thuật chụp cộng hưởng từ – MRI, Nhà xuất bản Đại học Quốc gia TP. Hồ Chí Minh, pp.1-168.
[12] Nguyễn QQ (2015), Bài giảng giải phẫu học, Tập 2, Nhà xuất bản Y Học, pp.1-386.
[13] Nguyễn TS (2009), Nghiên cứu một số đặc điểm lâm sàng và hình ảnh học của hội chứng hẹp ống sống thắt lưng cùng, Luận văn Thạc sĩ Y học, Đại học Y Hà Nội.
[14] Nguyễn TT (2017), Giáo trình nguyên lý vật lý cộng hưởng từ trong y học, Nhà xuất bản Đại học Huế, pp.84-99.
[15] Nguyễn TT (2018), Giáo trình Kỹ thuật chụp cộng hưởng từ, Nhà xuất bản Đại học Huế, pp.1-70.
[16] Phạm MT (2012), Kỹ thuật chụp Xquang, Nhà xuất bản Y học, pp.145-155.
[17] Phạm MT (2015), Kỹ thuật chụp cộng hưởng từ, Nhà xuất bản Y học, pp.57-58.
[18] Lưu XT (2013), “Nghiên cứu đặc điểm lâm sàng và cộng hưởng từ trong hội chứng đau thần kinh tọa”, Tạp chí Y học TP. Hồ Chí Minh, Tập 17 (Số 3), pp.143-148.
[19] Nguyễn V (2015), Nghiên cứu điều trị trượt đốt sống thắt lưng bằng phương pháp cố định cột sống qua cuống kết hợp hàn xương liên thân đốt, Luận án Tiến sĩ Y học, Đại học Y Hà Nội.
[20] Abbas Janan, Slon Viviane, Stein Dan et al. (2017), “In the quest for degenerative lumbar spinal stenosis etiology: The Schmorl’s nodes model”, BMC Musculoskeletal Disorders, 18 (164), pp.1-7.
[21] Alshamari Muhammed, Geijer Mats, Norrman Eva et al. (2015), “Low dose CT of the lumbar spine compared with radiography: A study on image quality with implications for clinical practice”, Acta Radiologica, 57 (5), pp.602-611.
[22] Amin Raj M., Andrade Nicholas S., Neuman Brian J. (2017), “Lumbar Disc Herniation”, Current Reviews in Musculoskeletal Medicine, Springer Science & Business Media, 10 (4), pp.507-516.
[23] Atalay A., Kozakcioglu M., Cubuk R. et al. (2009), “Degeneration of the lumbar spine and dual-energy X-ray absorptiometry measurements in patients without osteoporosis”, Clinical Imaging, 33 (5), pp.374-378.
[24] Azimi Parisa, Mohammadi Hassan Reza, Benzel Edward C. et al. (2015), “Lumbar Spinal Canal Stenosis Classification Criteria: A New Tool”, Asian Spine Journal, 9 (3), pp.399-406.
[25] Bartynski W. S., Lin L. (2003), “Lumbar root compression in the lateral recess: MR imaging, conventional myelography, and CT myelography comparison with surgical confirmation”, American Journal of Neuroradiology, 24 (3), pp.348-360.
[26] Butt S., Saifuddin A. (2005), “The imaging of lumbar spondylolisthesis”, Clinical Radiology, 60 (5), pp.533-546.
[27] Cheung Jason Pui Yin, Ng Karen Ka Man, Cheung Prudence Wing Hang et al. (2017), “Radiographic indices for lumbar developmental spinal stenosis”, Scoliosis and Spinal Disorders, 12 (3), pp.1-10.
[28] Cheung Jason Pui Yin, Samartzis D., Shigematsu H. et al. (2014), “Defining clinically relevant values for developmental spinal stenosis: A large-scale magnetic resonance imaging study”, Spine (Phila Pa 1976), 39 (13), pp.1067-1076.
[29] Choudhry Muhammad Naghman, Ahmad Zafar, Verma Rajat (2016), “Adolescent Idiopathic Scoliosis”, The Open Orthopaedics Journal, 10 (16), pp.143-154.
[30] Costello Richard F., Beall Douglas P. (2007), “Nomenclature and Standard Reporting Terminology of Intervertebral Disk Herniation”, Magnetic Resonance Imaging Clinics, 15 (2), pp.167-174.
[31] Covaro Augusto, Vilà-Canet Gemma, de Frutos Ana García et al. (2016), “Management of degenerative lumbar spinal stenosis: An evidence-based review”, EFORT Open Reviews, 1 (7), pp.267-274.
[32] Ebubedike Uzoamaka, Umeh Eric, Ogbole Godwin et al. (2017), “Pattern of lumbosacral magnetic resonance imaging findings in diagnosed cases of disc degenerative disease among Nigerian adults with low back pain”, West African Journal of Radiology, 24 (1), pp.25-29.
[33] Epstein Joseph A., Epstein Bernard S., Lavine Leroy (1962), “Nerve root compression associated with narrowing of the lumbar spinal canal”, Journal of Neurology, Neurosurgery, and Psychiatry, 25 (2), pp.165-176.
[34] Gammill Laura S., Bronner-Fraser Marianne (2003), “Neural crest specification: Migrating into genomics”, Nature Reviews Neuroscience, 4 (10), pp.795-805.
[35] Genevay Stephane, Atlas Steven J. (2010), “Lumbar Spinal Stenosis”, Best practice & research. Clinical rheumatology, 24 (2), pp.253-265.
[36] Gopinathan P. (2015), “Lumbar spinal canal stenosis-special features”, Journal of Orthopaedics, 12 (3), pp.123-125.
[37] Hao Ding-Jun, Duan Kun, Liu Tuan-Jiang et al. (2017), “Development and clinical application of grading and classification criteria of lumbar disc herniation”, Medicine®, 96 (47), pp.1-7.
[38] Hofmann Ulf Krister, Keller Ramona Luise, Walter Christian et al. (2017), “Predictability of the effects of facet joint infiltration in the degenerate lumbar spine when assessing MRI scans”, Journal of Orthopaedic Surgery and Research, 12 (180), pp.1-8.
[39] Hughes Andrew, Makirov Serik K., Osadchiy Valentin (2008), “Measuring spinal canal size in lumbar spinal stenosis: Description of method and preliminary results”, International Journal of Spine Surgery, 9 (3), pp.1-9.
[40] Jones R. A., Thomson J. L. (1968), “The narrow lumbar canal – A clinical and radiological review”, The Journal of bone and joint surgery – British volume, 50 (3), pp.595-605.
[41] Karavelioglu E., Kacar E., Gonul Y. et al. (2016), “Ligamentum flavum thickening at lumbar spine is associated with facet joint degeneration: An MRI study”, Journal of Back and Musculoskeletal Rehabilitation, 29 (4), pp.771-777.
[42] Karen Ka Man Ng, Jason Pui Yin Cheung (2017), “Is minimally invasive surgery superior to open surgery for treatment of lumbar spinal stenosis? A systematic review”, Journal of Orthopaedic Surgery, 25 (2), pp.1-11.
[43] Kim Hyeun Sung, Ju Chang Il, Kim Seok Won et al. (2015), “Lying Down Instability Undetected on Standing Dynamic Radiographs”, Journal of Korean Neurosurgical Society, 58 (6), pp.560-562.
[44] Kitab S. A., Alsulaiman A. M., Benzel E. C. (2014), “Anatomic radiological variations in developmental lumbar spinal stenosis: A prospective, control-matched comparative analysis”, The Spine Journal, 14 (5), pp.808-815.
[45] Kuisma Mari (2009), Magnetic resonance imaging of lumbar degenerative bone marrow (Modic) changes – Determinants, natural course and association with low back pain, Doctoral Dissertation, University Of Oulu.
[46] Kumar Manish, Garg Gaurav, Singh L. R. et al. (2011), “Epidemiology, Pathophysiology and Symptomatic Treatment of Sciatica: A Review”, International Journal of Pharmaceutical & Biological Archives 2(4), pp.1050-1061.
[47] Kumar Yogesh, Hayashi Daichi (2016), “Role of magnetic resonance imaging in acute spinal trauma: A pictorial review”, BMC Musculoskeletal Disorders, 17 (310), pp.1-11.
[48] Kushchayev Sergiy V., Glushko Tetiana, Jarraya Mohamed et al. (2018), “ABCs of the degenerative spine”, Insights into Imaging, Springer Berlin Heidelberg, 9 (2), pp.253-274.
[49] Lee Guen Young., Lee Joon Woo., Choi Hee Seok et al. (2011), “A new grading system of lumbar central canal stenosis on MRI: An easy and reliable method”, Skeletal Radiol, 40 (8), pp.1033-1039.
[50] Lee Seung Yeop, Kim Tae-Hwan, Oh Jae Keun et al. (2015), “Lumbar Stenosis: A Recent Update by Review of Literature”, Asian Spine Journal, 9 (5), pp.818-828.
[51] Lee Seunghun, Lee J. W., Yeom J. S. et al. (2010), “A practical MRI grading system for lumbar foraminal stenosis”, American Journal of Roentgenology, 194 (4), pp.1095-1098.
[52] Lim Young Su, Mun Jong-Uk, Seo Mi Sook et al. (2017), “Dural sac area is a more sensitive parameter for evaluating lumbar spinal stenosis than spinal canal area: A retrospective study”, Medicine®, 96 (49), pp.1-5.
[53] Lurie Jon, Tomkins-Lane Christy (2016), “Management of lumbar spinal stenosis”, British Medical Journal (Online), 352 (doi: 10.1136/bmj.h6234), pp.1-13.
[54] Ly Justin Q. (2007), “Systematic approach to interpretation of the lumbar spine MR imaging examination”, Magnetic Resonance Imaging Clinics of North America, 15 (2), pp.155-166.
[55] Mahmood Tabatabaei Seyed, Saeid Seddighi Amir, Afsoun Seddighi et al. (2012), “Clinical Results of 30 years surgery on 2026 patients with lumbar disc herniation”, World Spinal Column Journal, 3 (3), pp.80-86.
[56] Mamisch Nadja, Martin Brumann, Juerg Hodler et al. (2012), “Radiologic criteria for the diagnosis of spinal stenosis: Results of a Delphi survey”, Radiology, 264 (1), pp.174-179.
[57] Manfrè Luigi (2016), “Imaging and Symptoms of Spinal Canal Stenosis”, Spinal Canal Stenosis, Springer, pp.1-5.
[58] Neil Badlani, Howard An (2012), “Congenital Lumbar Spinal Stenosis: Diagnostic Challenge and Treatment Options”, Contemporary Spine Surgery, 13 (6), pp.1-6.
[59] Netter Frank H. (2017), Atlas of Human Anatomy E-Book, 7 Edition, Elsevier Health Sciences, pp.161-186.
[60] Oxland Thomas R. (2016), “Fundamental biomechanics of the spine-What we have learned in the past 25 years and future directions”, Journal of Biomechanics, 49 (6), pp.817-832.
[61] Pfirrmann Christian W., Dora Claudio , Schmid Marius R. et al. (2003), “MR image-based grading of lumbar nerve root compromise due to disk herniation: Reliability study with surgical correlation”, Radiology, 230 (2), pp.583-588.
[62] Pierro Antonio, Cilla Savino, Maselli Giuseppina et al. (2017), “Sagittal Normal Limits of Lumbosacral Spine in a Large Adult Population: A Quantitative Magnetic Resonance Imaging Analysis”, Journal of Clinical Imaging Science, 7 (35), pp.1-7.
[63] Rahman Hawis Abdul Salam Abdul, Iacob Gabriel (2015), “General considerations in lumbar spinal stenosis”, Romanian Neurosurgery, 22 (1), pp.78-84.
[64] Rodrigues Luciano Miller Reis, Ueno Fabrício Hitoshi, Gotfryd Alberto Ofenhejm et al. (2014), “Comparison between different radiographic methods for evaluating the flexibility of scoliosis curves”, Acta Ortopedica Brasileira, 22 (2), pp.78-81.
[65] Rohen Johannes Wilhelm, Yokochi Chihiro, Lütjen-Drecoll Elke (2011), Color atlas of anatomy: A photographic study of the human body, 7 Edition, Baltimore: Wolters Kluwer Health/Lippincott Williams & Wilkins, pp.232.
[66] Schizas Constantin, Theumann Nicolas, Burn Alexandre et al. (2010), “Qualitative grading of severity of lumbar spinal stenosis based on the morphology of the dural sac on magnetic resonance images”, Spine (Phila Pa 1976), 35 (21), pp.1919-1924.
[67] Schöller Karsten, Alimi Marjan, Cong Guang-Ting et al. (2017), “Lumbar Spinal Stenosis Associated With Degenerative Lumbar Spondylolisthesis: A Systematic Review and Meta-analysis of Secondary Fusion Rates Following Open vs Minimally Invasive Decompression”, Neurosurgery, 80 (3), pp.355-367.
[68] Steurer Johann, Roner Simon, Gnannt Ralph et al. (2011), “Quantitative radiologic criteria for the diagnosis of lumbar spinal stenosis: A systematic literature review”, BMC Musculoskelet Disord, 12 (175), pp.1-9.
[69] Sultana Tahera, Alam Syed Asif Ul, Mostafa Syeda Nazlee et al. (2015), “Plain Radiographic Evaluation of Degenerative Changes of Lumbosacral Spine-Correlation with Magnetic Resonance Imaging Findings”, Faridpur Medical College Journal, 10 (2), pp.68-70.
[70] Takatalo Jani (2015), Degenerative findings on MRI of the lumbar spine: Prevalence, environmental determinants and association with low back symptoms, Doctoral Dissertation, University Of Oulu.
[71] Teichtahl Andrew J., Urquhart Donna M., Wang Yuanyuan et al. (2016), “Modic changes in the lumbar spine and their association with body composition, fat distribution and intervertebral disc height – A 3.0T – MRI study”, BMC Musculoskeletal Disorders, 17 (92), pp.2-7.
[72] Urrutia Julio, Besa Pablo, Campos Mauricio et al. (2016), “The Pfirrmann classification of lumbar intervertebral disc degeneration: An independent inter- and intra-observer agreement assessment”, European Spine Journal, 25 (9), pp.2728-2733.
[73] Vavruch Ludvig, Tropp Hans (2016), “A Comparison of Cobb Angle: Standing Versus Supine Images of Late-Onset Idiopathic Scoliosis”, Polish Journal of Radiology, 81 (doi:10.12659/PJR.895949), pp.270-276.
[74] Verbiest H. (1954), “A radicular syndrome from developmental narrowing of the lumbar vertebral canal”, The Journal of Bone and Joint Surgery – British volume, 36B (2), pp.230-237.
[75] Weber Clemens, Rao Vidar, Gulati Sasha et al. (2015), “Inter- and Intraobserver Agreement of Morphological Grading for Central Lumbar Spinal Stenosis on Magnetic Resonance Imaging”, Global Spine Journal, 5 (5), pp.406-410.
[76] Wilmink Jan T. (2010), Lumbar spinal imaging in radicular pain and related conditions: Understanding diagnostic images in a clinical context, Springer Science & Business Media, pp.5&110.
[77] Wu Binbin, Zhang Shaobo, Lian Qingquan et al. (2017), “Lumbar Scoliosis Combined Lumbar Spinal Stenosis and Herniation Diagnosed Patient Was Treated with “U” Route Transforaminal Percutaneous Endoscopic Lumbar Discectomy”, Case Reports in Orthopedics, 2017 (doi: 10.1155/2017/7439016), pp.1-6.
[78] Yoshiiwa Toyomi, Miyazaki Masashi, Notani Naoki et al. (2016), “Analysis of the Relationship between Ligamentum Flavum Thickening and Lumbar Segmental Instability, Disc Degeneration, and Facet Joint Osteoarthritis in Lumbar Spinal Stenosis”, Asian Spine Journal, 10 (6), pp.1132-1140.
[79] Yu Liedao, Wang Xuanwei, Lin Xiangjin et al. (2016), “The Use of Lumbar Spine Magnetic Resonance Imaging in Eastern China: Appropriateness and Related Factors”, PLOS ONE, 11 (1), pp.1-11.
[80] Yuan Shiguo, Zou Yucong, Li Yikai et al. (2016), “A clinically relevant MRI grading system for lumbar central canal stenosis”, Journal of Clinical Imaging, 40 (6), pp.1140-1145.